Unter der Reaktionsgeschwindigkeit versteht man die zeitliche Änderung der Konzentration bei chemischen Reaktionen[1].
Die physikalische Einheit der Konzentration ist mol/l, die zeitliche Änderung der Konzentration muss also in mol/l pro Sekunde oder Minute angegeben werden, geschrieben als mol * l-1 * s-1 bzw. min-1.
Messung der Reaktionsgeschwindigkeit
Für die Schulchemie sind zwei Methoden zur Messung der Reaktionsgeschwindigkeit wichtig, die volumetrische Messung mittels Kolbenprober sowie die gravimetrische Messung mittels Analysewaage. Beide Methoden eignen sich aber nur für Reaktionen, bei denen ein Gas freigesetzt wird, zum Beispiel die Umsetzung von Salzsäure mit Magnesium oder die Reaktion von Essigsäure mit Calciumcarbonat. Bei der volumetrischen Methode wird das gebildete Gas in einem Kolbenprober aufgefangen, aus der zeitlichen Volumenzunahme kann dann die Reaktionsgeschwindigkeit der Gasbildung berechnet werden. Bei der gravimetrischen Methode für die Gasentwicklung zu einem Gewichtsverlust, aus dem dann ebenfalls die Reaktionsgeschwindigkeit berechnet werden kann. Nähere Ausführungen dazu siehe "Messung der Reaktionsgeschwindigkeit" auf den Seiten der Stufe EF.
Andere Methoden beruhen auf einem Farbwechsel während der Reaktion, eventuell nach Zugabe von Indikatoren und dem Einsatz eines Photometers. Aus der Geschwindigkeit des Farbwechsels kann die Reaktionsgeschwindigkeit berechnet werden. Ein sehr eindrucksvoller und einfacher Versuch dazu ist die Umsetzung von Natriumthiocyanat mit Salzsäure. Bei dieser Reaktion reagieren die beiden klaren Lösungen zu einem trüben Produktgemisch. Der entstehende Schwefel macht das Produktgemisch immer undurchsichtiger. Man kann nun einfach die Zeit messen, die der Versuch benötigt, bis man durch den Erlenmeyerkolben nicht mehr hindurch sehen kann. Einzelheiten dazu siehe "Der Salzsäure-Thiosulfat-Versuch" auf den EF-Seiten.
Grundbegriffe
Durchschnittsgeschwindigkeit
Man misst die Konzentration c1 eines Eduktes oder Produktes zum Zeitpunkt t1, anschließend wiederholt man die Messung und misst die veränderte Konzentration c2 zum Zeitpunkt t2. Die Durchschnittsgeschwindigkeit ist dann
$\overset{\scriptscriptstyle-}{v} = \frac{c_{2} - c_{1}}{t_{2} - t_{1}}$Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
MomentangeschwindigkeitWährend die Durchschnittgeschwindigkeit sehr leicht zu berechnen ist, kann die Momentangeschwindigkeit oft nur sehr schwierig bestimmt werden. Unter der Momentangeschwindigkeit versteht man nämlich die Reaktionsgeschwindigkeit zu einem definierten Zeitpunkt t. Mathematisch gesehen ist die Momentangeschwindigkeit die Durchschnittsgeschwindigkeit über eine Zeitspanne, die gegen Null geht.
Stellt man beispielsweise die Zunahme des Wasserstoff-Volumens in einem Kolbenprober mit der Zeit graphisch als Kurve dar, dann wäre die Momentangeschwindigeit zu einem beliebigen Zeitpunkt t die Tangente an der Kurve zu diesem Zeitpunkt. Die Durchschnittgeschwindigkeit dagegen wäre eine Sekante, die die Kurve an zwei Stellen schneidet.
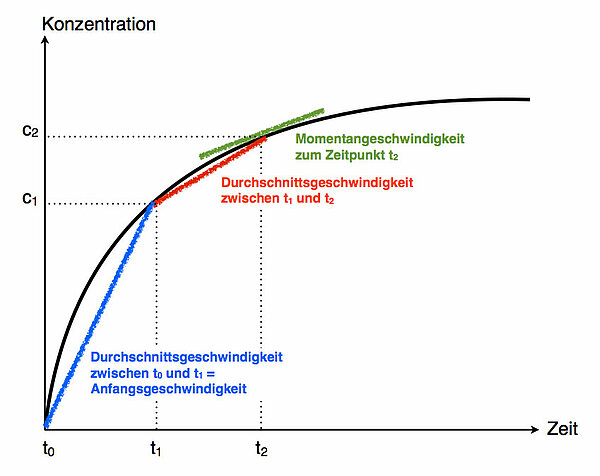
Anfangsgeschwindigkeit
Darunter versteht man die Reaktionsgeschwindigkeit zu Beginn einer chemischen Reaktion. Als Momentangeschwindigkeit ist die Anfangsgeschwindigkeit sehr schwer zu messen, daher verwendet man hierfür meistens die Durchschnittsgeschwindigkeit während der ersten fünf oder zehn Sekunden der Reaktion - die Zeitspanne richtet sich natürlich nach der Art der Reaktion selbst. Bei einer schnell ablaufenden Reaktion wie beispielsweise der Neutralisation einer Säure ist die Reaktion bereits nach Bruchteilen einer Sekunde vollständig beendet; mit Schulmitteln kann man hier so gut wie unmöglich eine Anfangsgeschwindigkeit bestimmen. Bei der beliebten Umsetzung von Salzsäure mit Zink oder Magnesium misst man, welches Wasserstoff-Volumen sich in den ersten fünf bis zehn Sekunden der Reaktion bildet. Variiert man dabei die Konzentration der Säure, kann man sehr schön die Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration der Säure darstellen.
Vertiefungen
Nähere Ausführungen zum Thema Reaktionsgeschwindigkeit finden sich auf den Seiten zur Reaktionskinetik der Stufe EF:
- Die Geschwindigkeit chemischer Reaktionen
- Von welchen Faktoren hängt die Reaktionsgeschwindigkeit ab?
- Messung der Reaktionsgeschwindigkeit
- Konzentrationsabhängigkeit der Reaktionsgeschwindigkeit
- Durchschnittsgeschwindigkeit und Momentangeschwindigkeit
- Der Salzsäure-Thiosulfat-Versuch - ein bimolekulare Reaktion
- Reaktionsordnung (mono-, bimolekulare Reaktionen)
- Temperatur und Geschwindigkeit, RGT-Regel und Stoßtheorie
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992