Durchführung
Geräte:
Fünf Erlenmeyerkolben, Stoppuhr,
Chemikalien:Natriumthiosulfatlösung (0,1 mol/l), Salzsäure (2 mol/l).
Durchführung:Man mischt in fünf Erlenmeyerkolben (100 ml) folgende Lösungen aus Natriumthiosulfatlösung (0,1 mol/l), Wasser und Salzsäure (2 mol/l) :
| Nummer | Na2S2O3 | Wasser | Salzsäure |
| 1 | 50 ml | 0 ml | 5 ml |
| 2 | 40 ml | 10 ml | 5 ml |
| 3 | 30 ml | 20 ml | 5 ml |
| 4 | 20 ml | 30 ml | 5 ml |
| 5 | 10 ml | 40 ml | 5 ml |
Zuerst werden das Thiosulfat und das Wasser in die Kolben gegeben. Erst dann gibt man die Salzsäure dazu. Sobald die Salzsäure im Kolben ist, stellt man diesen auf ein weißes Blatt Papier, auf dem sich ein schwarzes Zeichen befindet. Nun startet man eine Stoppuhr und misst die Zeit, die vergeht, bis man das schwarze Zeichen nicht mehr erkennen kann. Dieser Versuch ist mit jedem Erlenmeyerkolben zu wiederholen.
Auswertung
Bei der Reaktion entsteht Schwefel nach folgender Gleichung:

Da sich Schwefel bekanntlich nicht in Wasser löst, entsteht mit der Zeit eine immer "dickere" Suspension, welche nach und nach völlig undurchsichtig wird.
Als "Reaktionsgeschwindigkeit" wollen wir den Kehrwert der gemessenen Zeit verwenden (das ist zwar nicht ganz wissenschaftlich, reicht für unsere Zwecke aber völlig aus). Benötigt ein Kolben 20 Sekunden bis zum völligen Trübwerden, ein zweiter aber nur 10 Sekunden, so ist die Reaktionsgeschwindigkeit im zweiten Kolben doppelt so groß wie im ersten Kolben.
Zur Auswertung des Versuchs wird eine Graphik erstellt, in der die so ermittelte "Reaktionsgeschwindigkeit" gegen die Konzentration der Thiosulfationen aufgetragen wird.
Man erkennt, dass die Reaktionsgeschwindigkeit direkt von der Thiosulfat-Konzentration abhängt - im Idealfall müsste die Graphik eine Gerade zeigen:
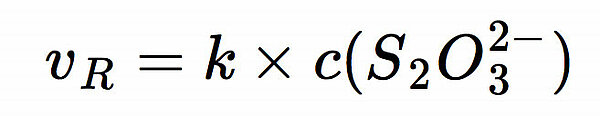
Dabei ist k die Geschwindigkeitskonstante.
Konkretes Beispiel
Wir wollen die oben beschriebene Auswertung nun gemeinsam durchführen. Dazu brauchen wir natürlich "echte" Messergebnisse. Da ich den Versuch mit meinen Schülern selbst noch nicht durchgeführt habe, denke ich mir einfach mal "vernünftige" Zahlen aus.
| Nummer | Na2S2O3 | Wasser | Salzsäure | Trübungszeit |
| 1 | 50 ml | 0 ml | 5 ml | 19 |
| 2 | 40 ml | 10 ml | 5 ml | 25 |
| 3 | 30 ml | 20 ml | 5 ml | 31 |
| 4 | 20 ml | 30 ml | 5 ml | 40 |
| 5 | 10 ml | 40 ml | 5 ml | 58 |
Ich habe hier mal die Thiosulfat-Menge (Volumen in ml) und den Kehrwert der Trübungszeit in Excel eingegeben, den Diagrammtyp "xy-Diagramm" gewählt und ein entsprechendes Diagramm erzeugt. Hier ist das Bildschirmphoto:

Auf der x-Achse sehen wir die Thiosulfat-Menge in ml, auf der y-Achse den Kehrwert der Trübungszeit, die "Reaktionsgeschwindigkeit" also. Wir können feststellen, dass die "Reaktionsgeschwindigkeit" mehr oder weniger linear von der "Konzentration" des Thiosulfats abhängt.