Reaktionsordnung
Bei vielen Versuchen kann man leicht zeigen, dass die Geschwindigkeit einer Reaktion von der Konzentration der Ausgangsstoffe abhängt. Denken Sie nur an die Reaktion zwischen Salzsäure und Zink oder Magnesium: Je konzentrierter die Säure, desto mehr Wasserstoff wird pro Zeiteinheit freigesetzt.
Bei der Reaktion von Salzsäure mit Natriumthiosulfat hängt die Zeit bis zur vollständigen Trübung nicht nur von der Konzentration der Salzsäure ab, sondern auch von der Thiosulfat-Konzentration.
Bei einer Reaktion mit zwei Ausgangsstoffen A, B bleibt aber die Frage offen, ob die Reaktionsgeschwindigkeit nur von A, nur von B oder sowohl von A wie auch von B abhängt.
Mit ausgeklügelten Versuchsanordnungen hat man nun herausgefunden, dass es - bezogen auf die sogenannte Reaktionsordnung - zwei Klassen von chemischen Reaktionen gibt: Reaktionen erster Ordnung und Reaktionen zweiter Ordnung.
Reaktionen erster Ordnung
Bei Reaktionen erster Ordnung hängt die Reaktionsgeschwindigkeit nur von der Konzentration eines Stoffes ab. Wenn nur ein Edukt vorhanden ist, so ist klar, dass die Geschwindigkeit nur von dessen Konzentration abhängen kann. Solche Reaktionen bezeichnet man daher auch als monomolekulare Reaktionen.
Beispiele für monomolekulare Reaktionen
Ganz typische und bekannte Beispiele für monomolekulare Reaktionen sind Dissoziationen sowie Isomerisierungen (Spektrum Lexikon der Chemie). Auch in dem Kinetik-Skript der Uni Leipzig werden Isomerisierungen und Zerfallsreaktionen als typische (und einzige) Beispiele genannt.
Aber ganz so einfach, wie man denkt, verhält es sich leider nicht. In dem Artikel "Monomolekulare Reaktionen" aus dem Lexikon der Chemie ist beispielsweise von Gasphasenreaktionen die Rede, die je nach Reaktionsbedingungen monomolekular oder auch bimolekular verlaufen können.
Und auch mit der Dissoziation von Molekülen verhält es sich nicht so ganz einfach, wie man zunächst denkt. Wenn man konzentriete Essigsäure mit Wasser vermischt, so geben die Essigsäure-Moleküle Protonen an Wasser-Moleküle ab. Damit es zu dieser Dissoziation kommt, müssen aber nicht nur Essigsäure-Moleküle anwesend sein, sondern auch Wasser-Moleküle. Also sollte die Geschwindigkeit dieser Protonenübertragung sowohl von c(Essigsäure) wie auch von c(Wasser) abhängen.
Pseudomonomolekulare Reaktionen
Ein Edukt liegt im Überschuss vor
Oft gibt es Reaktionen mit zwei oder mehr Edukten, die trotzdem wie eine monomolekulare Reaktion ablaufen; die Reaktionsgeschwindigkeit wird nur von der Konzentration eines Eduktes beeinflusst.
Meistens ist das der Fall, wenn ein Edukt im Überschuss vorliegt. Als Beispiel mag hier die Reaktion zwischen Salzsäure und Magnesium gelten. Gibt man genug Magnesiumpulver in den Erlenmeyerkolben, so hängt die Geschwindigkeit der Wasserstoff-Entwicklung ausschließlich von der Konzentration der Salzsäure ab. Ähnlich ist es, wenn man ein großes Becherglas mit Wasser füllt und dann etwas konz. Essigsäure dazugibt. Hier wird die Zahl der pro Sekunde gebildeten Oxonium-Ionen auch nicht mehr von der "Wasserkonzentration" beeinflusst, sondern nur noch von der Essigsäure-Konzentration.
Eine Reaktion läuft in mehreren Schritten abViele Reaktionen der organischen Chemie laufen in mehreren Reaktionsschritten ab. Bei der monomolekularen Nucleophilen Substitution (SN1) gibt es beispielsweise zwei Reaktionsschritte. Im ersten Reaktionsschritt zerfällt das Halogenalkan R-X in ein Carbokation (Carbenium-Ion) und ein Halogenid-Ion. Im zweiten Reaktionsschritt reagiert das Carbokation mit einem anderen Anion zu dem endgültigen Reaktionsprodukt. Formal sieht die Reaktion so aus:
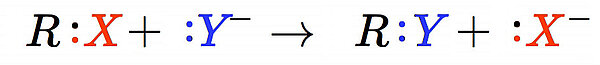
Zwei Edukte R:X und :Y- reagieren zu zwei Produkten R:Y und :X-. Trotzdem hängt die Geschwindigkeit dieser Reaktion nur von der Konzentration c(RX) ab. Wie kommt das?
Die Ursache liegt darin, dass die Reaktion in zwei Schritten abläuft, und dass der erste Schritt, nämlich der heterolytische Zerfall von R:X, langsamer verläuft als die Addition des Anions :Y- an das zwischenzeitlich entstandene Carbo-Kation R+. Bei einer Fahrradkette wird die Gesamtstabilität von der Haltbarkeit des schwächsten Gliedes bestimmt. Ähnlich ist es bei chemischen Reaktionen, die in mehreren Schritten ablaufen. Die Gesamtgeschwindigkeit hängt von der Geschwindigkeit des langsamsten Schrittes ab. Dieser Schritt wird daher auch als der geschwindigkeitsbestimmende Schritt bezeichnet. Bei der SN1-Reaktion ist die Dissoziation des Halogenalkans R:X der geschwindigkeitsbestimmende Schritt. Und da es sich hierbei um eine Dissoziation handelt, die monomolekular abläuft, ist auch die Gesamtreaktion eine monomolekulare Reaktion. Aber eben nur eine pseudomonomolekulare Reaktion.
Die SN1-Reaktion ist ein schönes Beispiel dafür, dass Molekularität (2 Edukte) und Ordnung (1; monomolekular) einer chemischen Reaktion nicht immer übereinstimmen müssen.
Reaktionen zweiter Ordnung
Bei den sogenannten bimolekularen Reaktionen müssen wirklich zwei verschiedene Teilchen zusammenstoßen, damit es zu einem Reaktionsschritt kommt. Viele chemische Reaktionen, vielleicht sogar die meisten, laufen nach diesem Schema ab.
Die Reaktion von Salzsäure mit Natriumthiosulfat ist ein schönes Beispiel für eine bimolekulare Reaktion, genauso wie die Nucleophile Substitution, die nach dem SN2-Mechanismus verläuft. Hier müssen nämlich das Halogenalkan und das Anion direkt zusammenstoßen, damit es zur Substitution kommt.