Zielsetzung
Wir wollen nun untersuchen, wie die Geschwindigkeit der H2-Bildung von der Konzentration der Salzsäure abhängt. Dazu gibt es mehrere mögliche experimentelle Vorgehensweisen, die sich auch mit Schulmitteln realisieren lassen. Für den normalen Schulunterricht haben sich die volumetrische Methode und die gravimetrische Methode gut bewährt (siehe letzte Seite). Auf dieser Seite konzentrieren wir uns auf die volumetrische Methode, also die Methode, die einen Kolbenprober verwendet um das entstehende Wasserstoff-Volumen zu messen.
Variante 1
Der Kolbenprober-Versuch wird mit unterschiedlich konzentrierten HCl-Lösungen durchgeführt, zum Beispiel
- 2 mol/l
- 1 mol/l
- 0,5 mol/l
- 0,25 mol/l
- 0,125 mol/l
Ausgehend von einer 2-molaren Lösung können die Schülergruppen die Verdünnungsreihe selbst herstellen. Die Herstellung einer linearen Verdünnungsreihe ist etwas aufwendiger, kann aber auch im Schülerversuch realisiert werden:
- 2 mol/l
- 1,5 mol/l
- 1 mol/l
- 0,5 mol/l
Wir messen dann bei jedem Versuchsdurchgang, wie viel Wasserstoff innerhalb der ersten zehn Sekunden der Reaktion entsteht. Bei der höchsten Konzentration von 2 mol/l muss man schon etwas aufpassen, dass einem der Kolben nicht nach hinten herausfliegt, so heftig ist die Reaktion, zumindest wenn man Magnesium-Pulver im Überschuss verwendet. Bei Magnesium-Spänen oder Zink-Pulver tritt dieses Problem nicht auf. Dafür hat man dann ein anderes Problem. Bei den stark verdünnten HCl-Lösungen entsteht so gut wie kein Wasserstoff mehr, jedenfalls nicht in den ersten 10 Sekunden. Daher verwende ich in meinem Unterricht immer Magnesium-Pulver. Ein Kolbenprober ist mir dabei schon einmal kaputt gegangen, als der Kolben mit Macht nach hinten herausschoss, weil die Schüler ihn nicht festgehalten haben.
Vor- und Nachteile: Diese Methode ist einerseits sehr materialaufwendig (vier bis fünf Kolbenprober werden pro Gruppe gleichzeitig gebraucht, und welche Chemiesammlung verfügt schon über 30 Kolbenprober?) oder sehr zeitaufwendig (wenn man nicht so viele Kolbenprober zur Verfügung hat, müssen fünf oder sechs Messungen nacheinander durchgeführt werden).
Andererseits liefert diese Methode recht zuverlässige Ergebnisse, vor allem muss man die Schüler nicht groß herumrechnen lassen, wenn sie die Reaktionsgeschwindigkeit in Abhängigkeit von der HCl-Konzentration darstellen sollen. Die S. verstehen diesen Versuch und die Sachzusammenhänge sofort.
Variante 2
Wir benötigen nur einen einzigen Kolbenprober pro Gruppe, der absolut sauber arbeitet, bei dem der Kolben also nicht "hakelt", während er sich herausschiebt. Dann nehmen wir Salzsäure der Konzentration 1 mol/l und filmen den Kolbenprober mit unseren Smartphones. Der Versuch wird abgebrochen, wenn sich der Kolben nicht mehr nennenswert bewegt.
Vor- und Nachteile: Bei dieser Methode reicht ein Durchgang des Versuchs völlig aus, sie ist weder geräte- noch zeitaufwändig. Allerdings muss der Versuch mit dem Kolbenprober sehr sorgfältig durchgeführt werden, und die Messdaten müssen lückenlos protokolliert werden. Da aber inzwischen jeder Schüler ein Smartphone mit Videofunktion besitzt, sollte das kein Problem sein.
Obwohl diese Methode sehr einfach durchzuführen ist, bereitet die Auswertung der Ergebnisse den Schülern meistens große Schwierigkeiten.
Ergebnisse
Variante 1
Hier bekommt man sehr schnell heraus, dass die Reaktionsgeschwindigkeit linear mit der Konzentration der Salzsäure zunimmt - im Idealfall nach der Formel
V(H2)10s = k * c(HCl)Mit dem Ausdruck auf der linken Seite der Formel ist das in den ersten 10 Sekunden gebildete Wasserstoff-Volumen gemeint, das quasi ein Maß für die Reaktionsgeschwindigkeit ist. Wenn man dieses Volumen kennt, kann man damit auch die Stoffmenge an Wasserstoff berechnen, die sich gebildet hat, und wenn man diese Stoffmenge durch die Zeit (10 Sekunden) teilt, erhält man die Durchschnittsgeschwindigkeit während der ersten 10 Sekunden. Diese Durchschnittsgeschwindigkeit ist der Konzentration c(HCl) proportional, und die Konstante k ist die sogenannte Geschwindigkeitskonstante.
Variante 2Wenn man die Bewegung des Kolbens filmt und dann das Video auswertet, kann man eine Tabelle bzw. eine Graphik anfertigen, die vielleicht so aussieht:
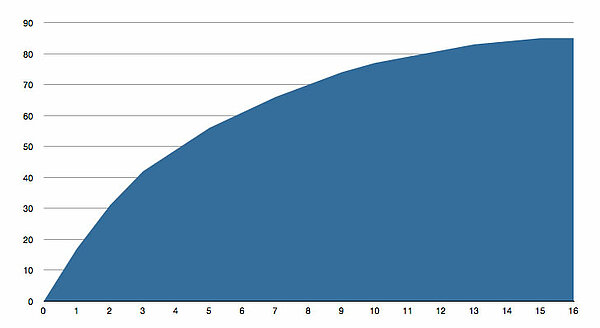
Im Laufe der Zeit wird pro Zeiteinheit immer weniger Wasserstoff gebildet, bis schließlich das Volumen im Kolbenprober gar nicht mehr zunimmt. Man sieht also sofort, dass die Reaktionsgeschwindigkeit als erste Ableitung der Volumenzunahme immer kleiner wird und gegen den Wert Null strebt.
Das Problem bei dieser Methode ist jetzt, wie entnimmt man der Graphik die Reaktionsgeschwindigkeit zum Zeitpunkt t? Und noch schlimmer: Wie ermittelt man die jeweilige Konzentration der Salzsäure zum Zeitpunkt t?. Erst wenn man beides gemacht hat, und zwar für möglichst viele Zeitpunkte, kann man die Reaktionsgeschwindigkeit in Bezug zur jeweiligen Konzentration der Salzsäure setzen.
Auf einer Spezialseite habe ich dieses Verfahren ausführlich dargelegt.
Für Experten der Q2:
Mit Hilfe des Lambert-Beerschen Gesetzes kann man die Geschwindigkeit chemischer Reaktionen sehr exakt kontinuierlich ermitteln. Wenn Sie darüber Näheres wissen wollen, gehen Sie einfach auf die Lexikon-Seite zum Lambert-Beerschen Gesetz.