Voraussetzungen
Wenn Sie diese Seite erfolgreich durcharbeiten wollen, sollten Sie folgende Kenntnisse haben:
- Spiegelbild-Isomerie bzw. Enantiomerie und Chiralität,
- allgemeiner Ablauf der SN2-Reaktion,
- Walden-Umkehr,
- Sterische Hinderung.
Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- dass das Nucleophil bei der SN2-Reaktion einen Rückseitenangriff durchführt,
- dass sterische Ursachen dafür verantwortlich sind,
- dass die Reaktion in einem einzigen Reaktionsschritt abläuft,
- dass der Übergangszustand pentavalent ist, also fünf Bindungen besitzt
- dass der pentavalente Übergangszustand planar ist
- dass es bei der Produkt-Bildung zu einer Inversion kommt.
Auf der vorherigen Seite hatten wir uns gefragt, wieso sich das organische Substrat während der bimolekularen Substitution in sein Spiegelbild verwandelt. Auf dieser Seite soll diese Frage geklärt werden.
Bildung des Übergangszustandes
Wir betrachten dazu erneut die Reaktion von 2-Brombutan mit Iodid-Ionen.

Wie man auf dem Bild sehen kann, nähert sich das Iodid-Ion dem Substrat von der Rückseite. Es handelt sich um einen typischen Rückseitenangriff, wie wir ihn vielleicht auch schon von der elektrophilen Addition her kennen (Bromierung von Ethen).
Wieso findet ein Rückseitenangriff statt?Die folgenden Überlegungen beziehen sich jetzt stets auf die Abbildung 1.
- Angenommen, das Iod-Anion würde das Molekül von "oben" angreifen. Dann müsste es an der Methylgruppe vorbeikommen, was nicht so ganz einfach ist.
- Wenn das Iod-Anion das Molekül von "unten" angreifen würde, wäre die Sache noch ungünstiger. Die Ethylgruppe ist größer als die Methylgruppe, ein Angriff von dieser Seite wäre also noch unwahrscheinlicher.
- Nun könnte das Iod-Anion ja auch von "rechts" angreifen. Dummerweise ist das Brom-Atom nicht nur sehr groß, sondern trägt auch noch eine negative Teilladung, wegen der hohen Elektronegativität von Brom. Es würde also nicht nur eine sterische Hinderung stattfinden (duch die Größe des Br-Atoms), sondern das negativ geladene Nucleophil würde auch noch elektrisch abgestoßen.
Die Annäherung von links - also durch einen Rückseitenangriff - hat immer noch die größte Wahrscheinlichkeit auf Erfolg.
Was hat es mit dem Übergangszustand auf sich?Wenn sich das Iodid-Ion dem Substrat von der Rückseite weit genug angenähert hat, bildet sich ein instabiler Übergangszustand, der im Abbildung 1 rechts zu sehen ist. Der Übergangszustand wird hier als pentavalent (fünfwertig) bezeichnet. Das mittlere C-Atom (grau hervorgehoben), die Methylgruppe, die Ethylgruppe und das H-Atom liegen in einer Ebene (blau gekennzeichnet). Das Iod-Atom und das Brom-Atom stehen senkrecht auf dieser Ebene. Natürlich hat das mittlere C-Atome keine fünf Bindungen. Die beiden gepunkteten Linien sollen andeuten, dass es sich bei der C-I und der C-Br-Bindung um "halbe" Bindungen handelt, so dass man insgesamt auf die Zahl von vier kovalenten Bindungen kommt. Im Expertenteil weiter unten wollen wir diese "halben" Bindungen näher analysieren.
Für Experten gibt es weiter unten noch einen kleinen Exkurs, in dem dieser pentavalente Übergangszustand mit Hilfe des Orbitalmodells genauer erklärt wird.
Bildung des Endprodukts
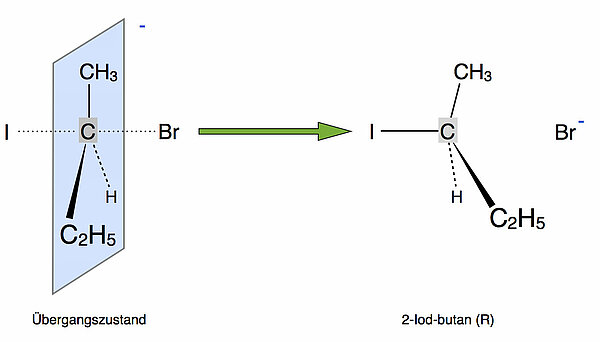
Auf Abbildung 2 erkennt man, wie das Brom-Atom den Übergangszustand als Bromid-Ion verlässt (Abgangsgruppe) und dabei die negative Ladung des Übergangszustandes mitnimmt. Es entsteht wieder ein tetraedrisches Produkt, das 2-Iodbutan. Wie bereits auf der vorherigen Seite ausgeführt, hat das Endprodukt dabei die spiegelbildliche Struktur des Eduktes (Inversion).
Energetische Betrachtungen
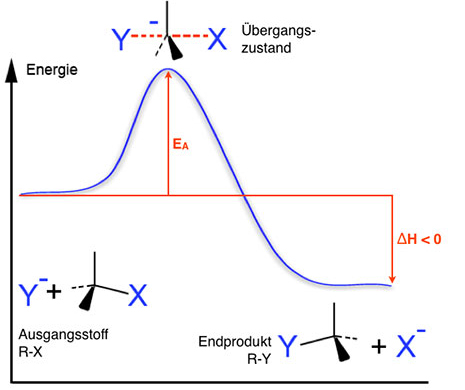
Beim SN2-Mechanismus erfolgen Andocken des Nucleophils Y und Abspaltung der Abgangsgruppe X gleichzeitig. Das Nucleophil "drückt" die Abgangsgruppe quasi aus dem Molekül heraus. Aus diesem Grund verläuft die Reaktion auch in einem Reaktionsschritt mit einem Übergangszustand.
Es handelt sich um eine bimolekulare Reaktion (Reaktion 2. Ordnung), da zwei Teilchen zusammenstoßen müssen, um den Übergangszustand zu bilden.
Aufgaben und Übungen
Wegen der Schulschließungen während der Corona-Krise halte ich es für sinnvoll, hier ein paar Aufgaben und Übungen unterzubringen, damit meine Schüler(innen) zu Hause etwas zum Nachdenken haben.
Aufgabe 1Chlorethan wird mit Kaliumiodid versetzt. Dabei kommt es zur Bildung von Iodethan und Kaliumchlorid. Entscheiden Sie begründend, ob es bei dieser Reaktion zu einer Walden-Inversion kommt oder nicht.
Aufgabe 2Informieren Sie sich über cis-trans-Isomerie bei Cycloalkanen. Zeichnen Sie dann das cis-4-Chlor-Methyl-cylohexan-Molekül möglichst räumlich sowie das Reaktionsprodukt, wenn cis-4-Chlor-Methyl-cylohexan mit Kaliumiodid reagiert hat. Geben Sie den Namen des Reaktionsproduktes an.
Auf dieser Seite finden Sie eine räumliche Darstellung des Moleküls, die Sie mit der Maus frei drehen können, falls der Browser das unterstützt.
Aufgabe 3 für ExpertenChlorethan wird mit einem großen Überschuss an Kaliumiodid versetzt. Der verantwortliche Chemiker vergisst, dass die Reaktion läuft und kommt erst ein paar Tage später wieder ins Labor. Nun untersucht er das Reaktionsprodukt und stellt fest, dass im Reaktionsprodukt 50% L-Iodethan und 50% R-Iodethan vorliegen. Beide Spiegelbild-Isomere sind also zu gleichen Anteilen vorhanden. Finden Sie eine Ursache für dieses seltsame Ergebnis und begründen Sie!
Für Experten
Für die Leute, die sich bereits mit dem Orbitalmodell des C-Atoms auskennen, wollen wir uns die Reaktion von 2-Brombutan zu 2-Iodbutan noch einmal unter diesem Aspekt anschauen.
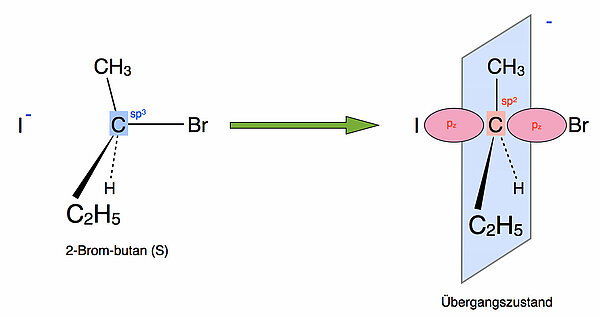
Das zentrale C-Atom im Edukt (blau gekennzeichnet) ist sp3-hybridisiert, daher hat das Produkt-Molekül eine tetraedrische Struktur. Wie kann man nun die pentavalente Anordnung des Übergangszustand erklären?
Das mittlere C-Atom liegt im Übergangszustand sp2-hybridisiert vor[1]. Es besitzt also ein pz-Orbital, das zwei Orbitallappen hat. Der eine Orbitallappen kann nun mit einem Orbital des Iodid-Ions überlappen, und der andere Orbitallappen kann mit einem Orbital des Brom-Atoms überlappen.
Der Übergang vom sp3-hybridisierten Zustand in den sp2-hybridisierten Zustand ist einerseits mit einem gewissen Energieaufwand verbunden. Je größer die Reste sind, die an dem zentralen C-Atom "hängen", desto größer wird dieser Energieaufwand, und desto unwahrscheinlicher wird eine nucleophile Substitution nach diesem bimolekularem Mechanismus.
Andererseits "wollen" die Alkylgruppen, die um das zentrale C-Atom gruppiert sind, einen möglichst großen Abstand voneinander haben, weil sich ihre Elektronenwolken gegenseitig abstoßen. Im sp2-hybridisierten Zustand ist dieser Abstand wegen der "flacheren" Bindungswinkel (120 º) etwas größer als im sp3-hybridisierten Zustand ( 109,5 º). Das wiederum erleichtert die Bildung des Übergangszustandes.
Insgesamt überwiegt in der Regel der zweite Faktor, so dass die Bildung des pentavalenten Übergangszustands erleichtert wird.
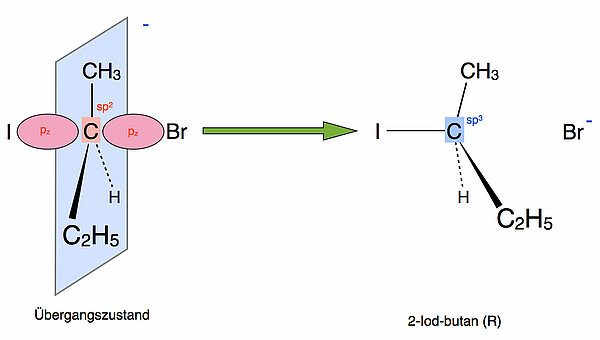
Bei der Bildung des Endproduktes geht das zentrale C-Atom wieder in den sp3-hybridisierten Zustand über. Dabei kommt es dann zur Walden-Umkehr bzw. zur Inversion der Raumstruktur.
Aufgaben für Experten
Aufgabe 1[1]
Wieso läuft folgende Reaktion NICHT ab:
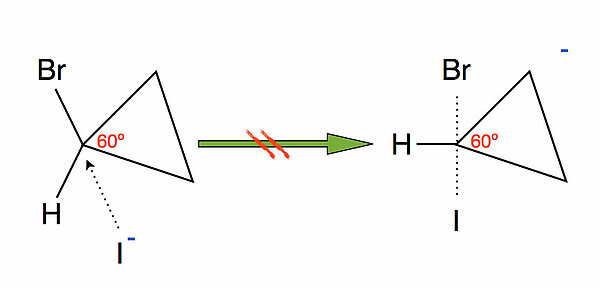
Bedingt durch die Ringstruktur des Cyclopropans hat das zentrale C-Atom einen C-C-C-Bindungswinkel von 60 Grad. Normalerweise haben sp3-hybridisierte C-Atome aber Bindungswinkel von 109,5 Grad, wie es der tetraedrischen Struktur entspricht. Der Ring ist also ziemlich "angespannt" bzw. energiereich.
Würde nun das Iodid-Ion das zentrale C-Atom nucleophil nach dem SN2-Mechanismus angreifen, so müsste das C-Atom in den sp2-hybridisierten Zustand übergehen. Die Spannung in dem Ring würde dadurch noch stärker anwachsen, nämlich von 60 º vs. 109,5 º beim Edukt auf 60 º vs. 120 º beim Übergangszustand.
Aufgabe 2[1]Die SN2-Reaktion von Brom-Cyclohexan mit Iodid-Ionen verläuft recht langsam, obwohl die Bindungswinkel recht günstig sind und die Bildung des Übergangszustandes nicht energetisch behindern. Wie kann man das erklären?
Betrachten wir dazu folgendes Bild:
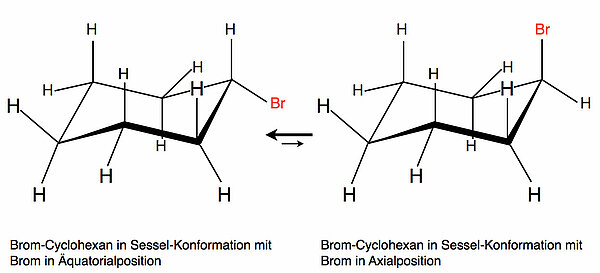
Auf dem Bild sehen wir das Brom-Cyclohexan in zwei verschiedenen Sessel-Konformationen. Links ist das Brom in äquatorialer Position, rechts in axialer Position. Beide Konfigurationen stehen miteinander im Gleichgewicht, wobei die Konfiguration mit Brom in äquatorialer Position überwiegt.
Schauen wir uns nun einmal an, wie der nucleophile Angriff eines Iodid-Ions (oder eines anderen Nucleophils) aussehen könnte, und zwar für beide Formen des Brom-Cyclohexans.
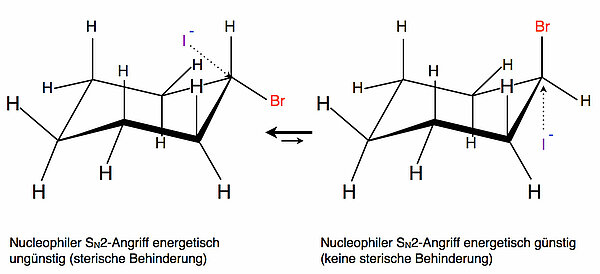
Bei der linken Konformation des Brom-Cyclohexans, wo sich also das Brom in der Äquator-Ebene befindet, ist der nucleophile Rückseitenangriff des Iodid-Ions energetisch sehr ungünstig, weil die vielen H-Atome den Angriff sterisch behindern.
Bei der rechten Konformation mit dem Brom in axialer Position liegt eine solche sterische Behinderung dagegen nicht vor. Hier kann die Substitution leicht stattfinden. Allerdings ist diese Konformation im Gleichgewicht unterrepräsentiert, so dass die Reaktion insgesamt sehr langsam vonstatten geht.
Quellen:
- Vorlesung Organische Chemie 1.17 von Prof. G. Dyker: "Nucleophile Substitution" (YouTube)
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Morrison/Boyd, Organic Chemistry, 7th Edition, 2011
- Carey/Sundberg, Organische Chemie - ein weiterführendes Lehrbuch, Weinheim 1995