
Hier noch einmal die bekannte Darstellung des C-Atoms nach dem Orbitalmodell - ohne Hybridisierung. Nun mal zur Abwechslung eine völlig andere Darstellung:
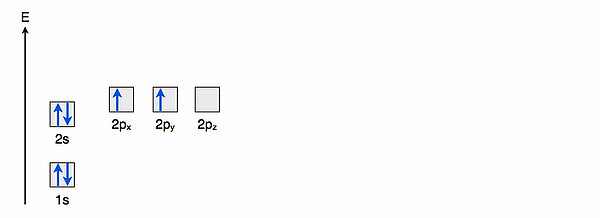
Hier sehen wir die Orbitale des C-Atoms schematisch dargestellt. Jedes quadratische Kästchen steht für ein Orbital. Die blauen Pfeile symbolisieren die Elektronen in den Orbitalen. Ein Orbital fasst maximal zwei Elektronen, die sich in ihrem Spin ("Drehrichtung") unterscheiden müssen. Das 1s-Orbital (die ehemalige K-Schale) ist am energieärmsten, deswegen befindet sich der Kasten für das 1s-Orbital ganz unten in der Abbildung. Das 2s-Orbital auf der L-Schale ist schon energiereicher, darum ist es in der Abbildung über dem 1s-Orbital angeordnet. Die 2p-Orbitale befinden sich zwar ebenfalls auf der L-Schale, sind aber trotzdem ein wenig energiereicher als das 2s-Orbital. Das kann man in der Abbildung recht gut erkennen.
Hybridisierung
Um zu erklären, wieso das C-Atom vier gleichwertige Bindungen eingehen kann, hat man das Konzept der Hybridisierung erfunden.
PromotionDer erste Schritt dieser Hybridisierung ist die Promotion ("Beförderung") eines Elektrons aus dem 2s-Orbital in das leere 2pz-Orbital, wie die folgende Abbildung zeigt:
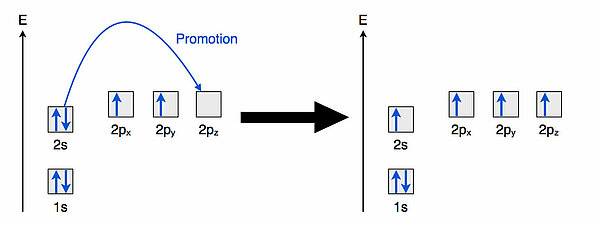
Das eine Elektron des 2s-Orbitals wird in ein Orbital mit höherer Energie befördert; die dazu erforderliche Promotionsenergie beträgt 400 kJ/mol. Dieser Vorgang läuft nur deswegen "freiwillig" ab, weil im übernächsten Schritt Energie gewonnen wird.
Hybridisierung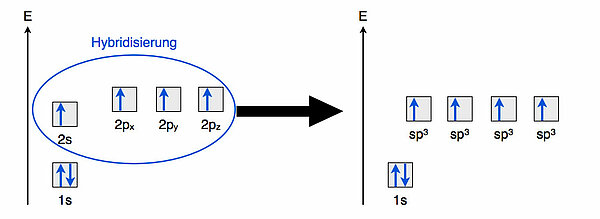
Bei der Hybridisierung wird das einfach besetzte 2s-Orbital mit den drei einfach besetzten 2p-Orbitalen "vermischt", dabei entstehen vier energetisch gleichwertige sp3-Hybridorbitale. Diese vier Hybridorbitale stoßen sich nun aufgrund ihrer negativ geladenen Elektronen gegenseitig ab, und der Zustand minimaler Energie ist die tetraedrische Anordnung der vier Hybridorbitale, wie wir es bereits vom Kugelwolkenmodell her kennen. Diese Hybridisierung erfordert übrigens keine Hybridisierungsenergie, da sich die Gesamtenergie des C-Atoms durch die Hybridisierung nicht ändert. In der Zeichnung kann man gut sehen, dass das Energieniveau der vier Hybridorbitale etwas niedriger liegt als das der p-Orbitale, aber höher als das des 2s-Orbitals.
CH4-Bildung unter EnergiegewinnDer nicht-hybridisierte Kohlenstoff könnte theoretisch CH2-Moleküle bilden. Jedes C-Atom wäre mit zwei H-Atomen verbunden. Bei der Bildung einer solchen kovalenten Bindung wird ein bestimmter Betrag an Bindungsenergie freigesetzt; das CH2-Molekül hätte also weniger Energie als das C-Atom und zwei H-Atome zusammen.
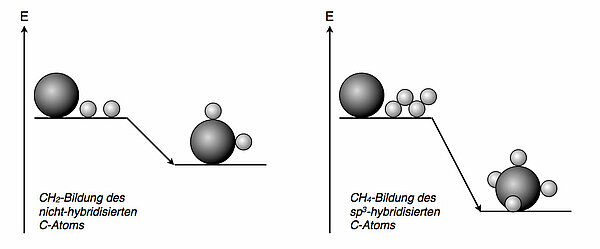
Durch die Hybridisierung hat das C-Atom nun vier energetisch gleichwertige Hybridorbitale mit je einem ungepaarten Elektron. Das C-Atom kann auf diese Weise also vier kovalente Bindungen zu anderen Atomen bilden. Der Energiegewinn ist also doppelt so groß bei der Bildung des CH4-Moleküls wie bei der Bildung des CH2-Moleküls des nicht-hybridisierten C-Atoms.
Der Energiegewinn bei der Bildung der vier C-H-Bindungen ist nun wesentlich größer als die zur Promotion des 2s-Elektrons erforderliche Promotionsenergie, so dass der Gesamtvorgang Promotion -> Hybridisierung -> CH4-Bildung exotherm ist.