Struktur
Konstitution
Das zweiteinfachste Alkan ist das Ethan C2H6, seine Konstitution kann beschrieben werden als "ein C-Atom, das über eine kovalente Einfachbindung mit einem zweiten C-Atom verbunden ist. Jedes der beiden C-Atome ist außerdem mit drei H-Atomen verbunden".

An diesem Kugel-Stab-Modell sieht man das ganz gut.
StrukturdatenAlle Bindungswinkel im Ethan-Molekül betragen 109,5º, weil beide C-Atome sp3-hybridisiert sind. Die sechs C-H-Bindungen sind relativ unpolar, da der EN-Unterschied zwischen Kohlenstoff (2,55) und Wasserstoff (2,20) recht klein ist. Die C-C-Einfachbindung ist völlig unpolar, weil beide C-Atome die gleiche Elektronegativität haben. Die Bindungslänge der C-H-Bindungen beträgt 109 pm, während die C-C-Bindung 154 pm lang ist.
KonformationenWegen der freien Drehbarkeit der C-C-Einfachbindung kommt das Ethan-Molekül in vielen verschiedenen Konformationen vor.
Hier sehen Sie ein Photo von einem Ethan-Modell, einmal in der gestaffelten Konformation, und einmal in der verdeckten Konformationen. Neben diesen beiden Konformationen gibt es natürlich noch unendlich viele andere Konformationen, die aber keine besonderen Namen haben:

Durch Drehung um die C-C-Einfachbindung kann die eine Konformation leicht in die andere übergehen, es ist lediglich ein kleiner "Energieberg" (Torsionsenergie) zu überwinden, wie das nächste Bild zeigt:
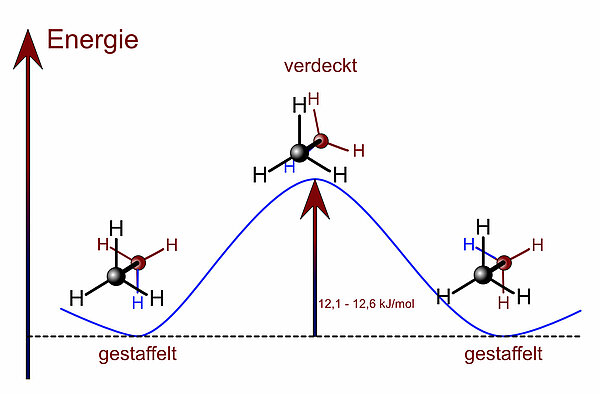
Die Torsionsenergie (Drehungsenergie) des Ethans ist mit 12,1 bis 12,6 kJ/mol extrem klein. Die Folge davon ist, dass sich die beiden Methylgruppen des Moleküls bei Zimmertemperatur ständig um die C-C-Achse gegeneinander verdrehen. Allerdings gibt es ein Energieminimum, wenn das Ethan-Molekül in der sogenannten gestaffelten Konformation vorliegt. Diese Konformation ist besonders stabil, daher liegen ständig ca. 99% aller Ethan-Moleküle in dieser Konformation vor.
Material für den Unterricht
Zum Thema "Konformationen" können Sie sich ein zweiseitiges Arbeitsblatt herunterladen.

Dieses Arbeitsblatt ist für den doppelseitigen Druck optimiert, wie man gut an den Seitenrändern erkennen kann.
Vorkommen
Ethan ist nach Methan der Hauptbestandteil des Erdgases. Aber auch von Mikroorganismen wird Ethan gebildet, vor allem beim Faulen organischer Stoffe unter Luftabschluss (Sumpfgas, Biogas).
Physikalische Eigenschaften
Der Schmelzpunkt von Ethan liegt mit -172 ºC sehr niedig, der Siedepunkt beträgt -88,6 ºC, das ist deutlich höher als der von Methan.
Ansonsten ist Ethan farb- und geruchlos; seine Dichte beträgt 1,36 g/l bei 0 ºC, was etwas geringer ist als die Dichte von Sauerstoff (1,43 g/l) und Stickstoff (1,25 g/l). Somit ist Ethan etwas leichter als Luft, aber schwerer als Methan (0,656 g/l).
Zu den physikalischen Eigenschaften der höheren Alkane finden Sie Informationen auf der entsprechenden Seite.
Chemische Eigenschaften
Als Alkan geht Ethan vornehmlich zwei Reaktionen ein: Einmal die Oxidation zu Kohlendioxid und Wasser, und dann die Reaktion mit Halogenen zu Halogenethan. In der Industrie wird Ethan außerdem zur Synthese von Ethen verwendet. Informationen zu den Reaktionen der Alkane allgemein finden Sie auf dieser Seite.
OxidationBei der Reaktion mit Sauerstoff nach der Gleichung
$C_{2}H_{6} + 3,5 O_{2} \to 2 CO_{2} + 3 H_{2}O$ mit $ \Delta H = -1559,7 kJ/mol$
wird eine große Menge an Wärmeenergie freigesetzt, was vor allem bei der Verbrennung von Erdgas eine wichtige Rolle spielt.
HalogenierungDurch eine radikalische Substitution kann Ethan chloriert oder bromiert werden.
Didaktische Bemerkungen zur Halogenierung von Alkanen
Die meisten Chlor- und Brom-Ethane werden allerdings durch elektrophile Addition von HCl, HBr, Cl2 oder Brl2 an Ethen oder Ethin hergestellt. Hier die Ergebnisse einer schnellen Recherche:
Chlorethan
- Chlorethan: Addition von HCl an Ethen
- 1,1-Dichlorethan: Anlagerung von HCl an Vinylchlorid
- 1,2-Dichlorethan: Addition von Cl2 an Ethen
- 1,1,1-Trichlorethan: Chlorierung von 1,1-Dichlorethan, Addition von HCl an 1,1-Dichlorethen
- 1,1,2-Trichlorethan: Chlorierung von 1,2-Dichlorethan
- 1,1,1,2-Tetrachlorethan: Addition von Chlor an Ethin (Nebenprodukt)
- 1,1,2,2-Tetrachlorethan: Addition von Chlor an Ethin (Hauptprodukt)
- Pentachlorethan: Addition von Chlor an Trichlorethen
- Hexachlorethan: Addition von Chlor an Tetrachlorethen
Bromethan
- Bromethan: Umsetzung von Ethanol mit Phosphortribromid PBr3
- 1,2-Dibromethan: Addition von Brom an Ethen
- 1,1,2,2-Tetrabromethan: Addition von Brom an Ethin
Die anderen Bromethane wurden leider nicht gefunden. Wie man sieht, spielt die radikalische Substitution, also die Reaktion von Ethan mit einem Halogen, nur eine untergeordnete Rolle. Da stellt sich jetzt natürlich die Frage, wieso dieser Reaktionstyp in allen Schulbüchern derart verbreitet ist, wenn doch die elektrophile Addition für die industrielle Synthese viel relevanter ist. Bei der Verbrennung von Alkanen spielt die SR eine große Rolle, allerdings ist der Reaktionsablauf so komplex, dass er in Schulbüchern kaum berücksichtigt wird. Statt dessen wird fleißig Methan chloriert oder Ethan bromiert...
Synthese von Ethen
Bei der Synthese von Ethen aus Ethan findet eine Eliminierungsreaktion statt, genauer gesagt eine Dehydrierung:
$C_{2}H_{6} \to C_{2}H_{4} + H_{2}$
In Ländern, in denen viel Bioethanol hergestellt wird, kann Ethen auch durch Dehydratisierung von Ethanol gewonnen werden.
Darstellung
Herrmann Kolbe (1818-1884) stellte Ethan aus Essigsäure her; nach ihm wird diese Synthese dann auch als Kolbe-Synthese bezeichnet oder als Kolbe-Elektrolyse, denn das Verfahren funktioniert mit Gleichstrom. Am Pluspul gibt das Acetat-Ion ein Elektron ab und wird dann zum Acetat-Radikal. Dieses Radikal spaltet dann CO2 ab, es bildet sich ein Methyl-Radikal. Zwei dieser Methyl-Radikale vereinigen sich dann im letzten Schritt zu einem Ethan-Molekül.
Informationen zur allgemeinen Synthese und Darstellung der Alkane finden Sie auf einer eigenen Seite.