Siedetemperaturen
Im Vergleich zu anderen organischen Verbindungen haben Alkane sehr niedrige Siedetemperaturen. Dies ist auf die extrem geringe Polarität der C-H-Bindungen zurückzuführen. Alkan-Moleküle werden untereinander nur durch London-Kräfte zusammengehalten, die schwächste Form der van-der-Waals-Kräfte.
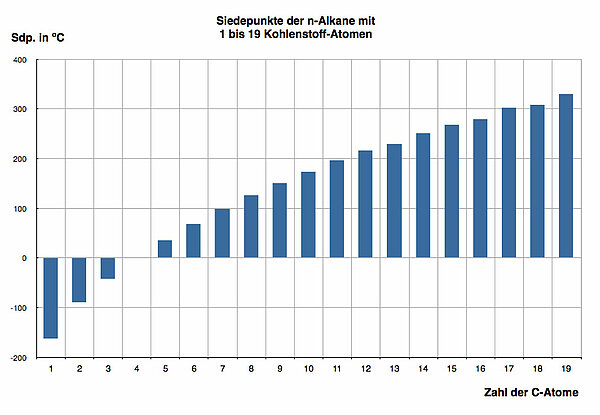
Interessant an dieser Graphik ist das kontinuierliche Ansteigen der Siedetemperatur innerhalb der homologen Reihe der Alkane. Das n-Butan hat einen Siedepunkt von -0,5 ºC, deshalb ist der entsprechende Balken in der Abbildung nicht zu sehen. Ab Pentan sind die Alkane bei Zimmertemperatur flüssig (Siedetemperatur von Pentan = 36,1 ºC).
Schmelztemperaturen
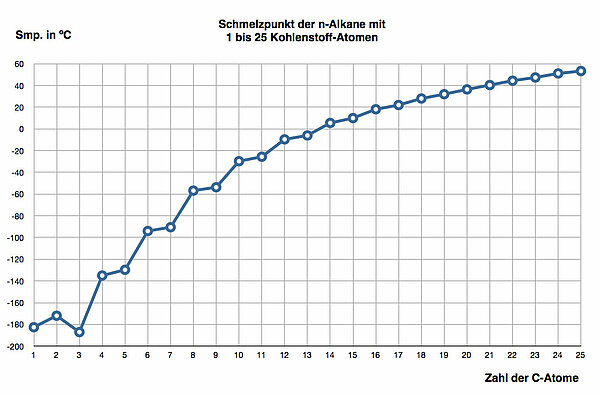
Auch die Schmelzpunkte der Alkane steigen mit der Zahl der C-Atome, allerdings nicht ganz so kontinuierlich wie die Siedepunkte. Das liegt daran, dass feste Alkane Kristallgitter bilden, und offensichtlich ist eine gerade Anzahl von C-Atomen irgendwie stabiler als eine ungerade Anzahl. Je länger die C-Ketten der Alkane werden, desto unerheblicher werden diese Unterschiede allerdings. Extrem ist dieses Phänomen, wenn man Ethan und Propan vergleicht.
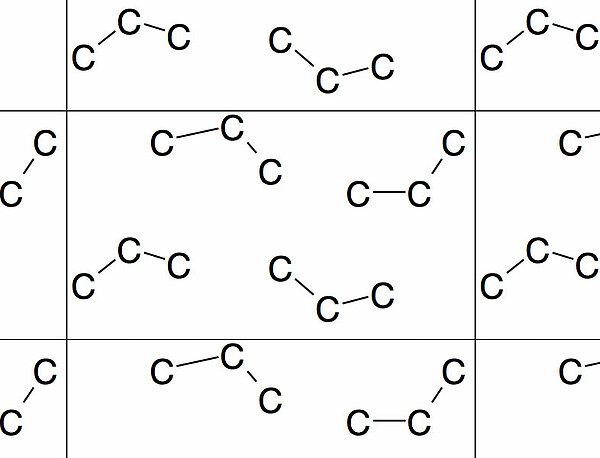
Dr. Himmelheber schreibt auf seiner Seite über die Kristallstruktur der Alkane:
"Die Stapelung von Propan ist so beschaffen, dass die Moleküle nur 63,2% der Elementarzelle füllen (bei 30 K). Folglich sind die Abstände zwischen den Molekülen insgesamt größer als z.B. bei Butan, und die Van-der-Waals-Kräfte entsprechend schwächer."
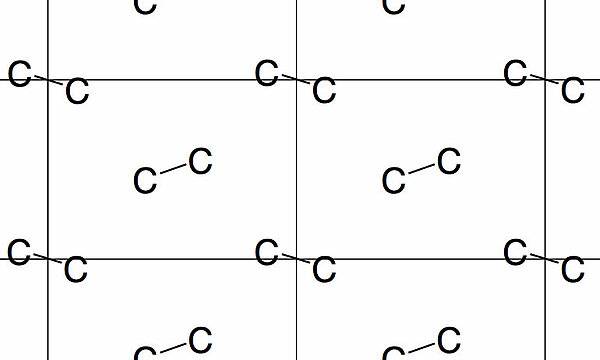
Im Ethan-Kristall sind die Ethan-Moleküle regelmäßiger angeordnet als im Propan-Kristall.
Viskosität
Unter der Viskosität versteht man so etwas wie "Zähflüssigkeit". Honig hat zum Beispiel eine sehr hohe Viskosität, die Viskosität von Wasser empfindet man als "normal", und Stoffe wie Benzin, Ether etc. haben eine geringe Viskosität.
Man kann die Viskosität eines Stoffes quantitativ ermitteln, indem man beispielsweise 50 ml der Flüssigkeit in eine Bürette gibt, die Bürette unten mit einem engen Glasrohr verschließt und dann die Zeit misst, die erforderlich ist, bis der Inhalt der Bürette ausgelaufen ist. Bei dünnflüssigem Honig würde das vielleicht 50 Sekunden dauern, bei Wasser vielleicht 10 Sekunden, und bei Pentan dann vielleicht 6 oder 7 Sekunden.
Alkane haben allgemein eine geringe Viskosität, zumindest wenn man die Zahl der C-Atome berücksichtig. Klar, ein Alkan mit 30 C-Atomen hat natürlich eine recht hohe Viskosität, aber andere organische Verbindungen mit der gleichen Anzahl von C-Atomen haben eine noch viel höhere Viskosität. Die geringe Viskosität der Alkane hängt natürlich ebenfalls mit den geringen Anziehungskräften zwischen den Alkan-Molekülen zusammen.
Zu diesem Thema gibt es ein tolles YouTube-Video, dass Sie sich auf jeden Fall ansehen sollten!
Dichte
Das spezifische Gewicht der flüssigen Alkane wie Pentan, Hexan und Heptan liegt unter dem Wert 1,0 g/cm3, wie er ja für Wasser gültig ist. Die Abstände zwischen den Alkan-Molekülen sind größer, so dass nicht so viele Alkan-Moleküle in ein bestimmtes Volumen hineinpassen. Die Ursache hierfür - Sie haben es sich bestimmt schon gedacht - sind wieder die geringen Anziehungskräfte zwischen den Alkan-Molekülen.
Wasserlöslichkeit
Was passiert, wenn sich ein Stoff wie Kochsalz, Alkohol oder Zucker in Wasser löst? Im Falle von Kochsalz gruppieren sich die Wasser-Dipole um die positiven und negativen Ionen des Salzes, es bilden sich Hydrathüllen, die die Ionen umgeben. Im Falle von Zucker oder Alkohol bilden die Wasser-Moleküle sogar Wasserstoffbrücken-Bindungen (H-Brücken) mit den OH-Gruppen der Alkohol- oder Zucker-Moleküle aus. Beide Phänomene, Hydrathüllen und H-Brücken, erklären die gute Wasserlöslichkeit vieler anorganischer und organischer Verbindungen.
Alkane dagegen können aufgrund ihrer unpolaren Struktur weder H-Brücken bilden noch sich wie Ionen verhalten und Wasser-Moleküle elektrisch anziehen. Aus diesem Grund verbinden sich die Wasser-Moleküle nicht mit den Alkan-Molekülen, sondern bleiben untereinander (bilden H-Brücken mit anderen Wasser-Molekülen).
Die Alkan-Moleküle müssen unter sich bleiben und bilden daher eine eigene Phase in dem Wasser. Aufgrund der geringen Dichte der Alkane schwimmt diese organische Alkan-Phase dann oben auf der wässrigen Phase.
Zu diesem Thema gibt es ein tolles YouTube-Video, dass Sie sich auf jeden Fall ansehen sollten!
Beziehungen zwischen Struktur und Eigenschaften
Das Struktur-Eigenschafts-Konzept ist eines der fünf Basiskonzepte der Chemie. Auch an den physikalischen Eigenschaften der Alkane lässt sich dieses wichtige Konzept aufzeigen. Dazu betrachten wir einmal das folgende Schema:
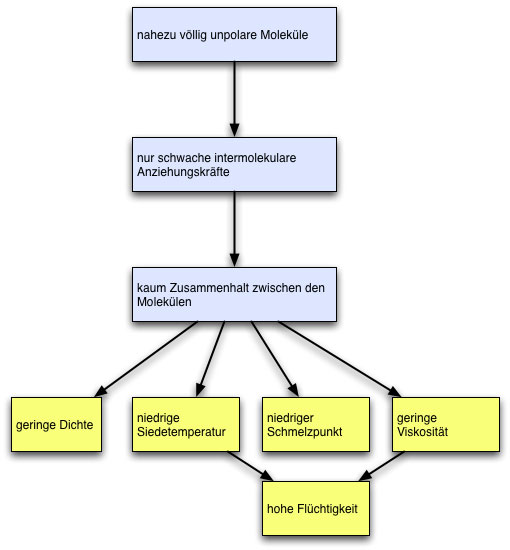
Alkane sind nahezu völlig unpolare Moleküle, daraus resultieren nur sehr schwache intermolekulare Anziehungskräfte, so dass kaum ein Zusammenhalt zwischen den Molekülen besteht. Daraus folgen dann die bekannten Eigenschaften der Alkane, die bereits weiter oben auf dieser Seite erörtert worden sind: geringe Dichte, niedrige Siedetemperatur, niedrige Schmelztemperatur, geringe Viskosität und - noch nicht erwähnt - eine hohe Flüchtigkeit; flüssige Alkane wie Pentan oder Hexan verdampfen sehr schnell.