Oxidation
Aus dem Alltag ist die Oxidation der Alkane nicht wegzudenken, schließlich ist es die Reaktion, die in jedem Verbrennungsmotor und in jeder Heizungsanlage abläuft, wenn sie mit Erdöl oder Erdgas betrieben wird. So allgegenwärtig diese Reaktion ist, so ist ihr Mechanismus doch noch weitgehend ungeklärt. Fest steht wohl, dass es sich um eine radikalische Reaktion handelt, die einerseits durch eine hohe Aktivierungsenergie (Erzeugung der Radikale) gekennzeichnet ist, andererseits durch eine hohe Reaktionsenthalpie.
Berechnung der Reaktionsenthalpie bei der Verbrennung von MethanDie Bindungsenergie ist eine charakteristische Größe für eine kovalente Bindung zwischen zwei Atomen. Angegeben wird dabei die Energiemenge in kJ, die zur Spaltung der kovalenten Bindung in genau 1 mol der Moleküle erforderlich ist.
Der Begriff Bindungsenergie ist Ihnen schon einmal begegnet, nämlich bei der Analyse der Bildung von Salzen wie NaCl. Die Chlor-Moleküle Cl2 mussten in Chlor-Atome gespalten werden, und dazu war Energie notwendig. Weil man die Energie zur Spaltung oder Dissoziation einer kovalenten Bindung benötigt, wird die Bindungsenergie manchmal auch als Bindungsdissoziationsenergie bezeichnet. Ein anderer bekannter Begriff ist Bindungsenthalpie. Für einen Chemiestudenten mag dieser Unterschied wichtig sein, für uns in der Schule aber nicht. Wir verwenden die drei Begriffe Bindungsenergie, Bindungsdissoziationsenergie und Bindungsenthalpie gleichwertig.
Was Sie sich dagegen merken sollten, ist Folgendes: Bei der Bildung einer kovalenten Bindung wird die Bindungsenergie wieder freigesetzt. Was ja auch logisch ist. Wenn man zur Spaltung einer Bindung Energie aufwenden muss, sollte diese bei der Entstehung einer solchen Bindung wieder frei werden.
Bei der Bildung einer kovalenten Bindung wird die Bindungsenergie wieder freigesetzt.
Bei Molekülen mit mehr als einer kovalenten Bindung muss man aufpassen. Das Wasser-Molekül besitzt zum Beispiel zwei O-H-Bindungen. Während man für die homolytische Spaltung der ersten O-H-Bindung einen Energiebetrag von 497 kJ/mol aufwenden muss, reicht für die Spaltung der zweiten O-H-Bindung bereits ein Betrag von 429 kJ/mol. Daher gibt man für die Bindungsenergie der O-H-Bindung stets den Mittelwert von 463 kJ/mol an.
Hier ein paar typische mittlere Bindungsenthalpien für eine Temperatur von 25 ºC. Ich habe diese Werte dem Schulbuch "Chemie heute SII" aus dem Schroedel-Verlag entnommen.
| Bindung | Bindungsenthalpie in kJ/mol |
| C - H | 413 |
| C - C | 348 |
| C - O | 358 |
| C = O | 745 |
| H - O | 463 |
| O = O | 498 |
Wir wollen nun die Reaktionsenthalpie der Verbrennung von Methan CH4 berechnen. Dazu stellen wir zunächst die vollständige Reaktionsgleichung auf:
$CH_{4} + 2 O_{2} \to CO_{2} + 2 H_{2}O$
Zunächst müssen vier C-H-Bindungen gespalten werden, dafür müssen 4 x 413 = 1652 kJ aufgewandt werden. Außerdem müssen zwei O=O-Bindungen gespalten werden, was 2 x 498 = 996 kJ kostet. Insgesamt haben wir bis jetzt 2648 kJ/mol in die Reaktion hineingesteckt.
Es entstehen aber auch einige neue Bindungen. Zunächst einmal bilden sich zwei C=O-Bindungen im Kohlendioxid, dabei werden 2 x 745 = 1490 kJ/mol frei. Außerdem bilden sich vier O-H-Bindungen in den Wasser-Molekülen, was zur Freisetzung von 4 x 463 = 1852 kJ/mol führt. Insgesamt entstehen also 3342 kJ/mol, das sind 694 kJ/mol mehr als zuvor in die Reaktion investiert wurden.

Die Reaktion verläuft also exotherm, und die Reaktionsenthalpie beträgt -694 kJ/mol.
Reaktionsmechanismus der Oxidation
Bei der Oxidation der Alkane handelt es sich allem Anschein nach um eine radikalische Kettenreaktion, deren genauer Mechanismus aber noch weitgehend ungeklärt ist. Nach der Dissertation von Crina I. Heghes (Heidelberg, September 2006) besteht der Mechanismus der Verbrennung niedriger Alkane (Methan, Ethan, Propan und Butan) aus 412 Elementarreaktionen und enthält 61 verschiedene Edukte, Zwischenprodukte und Produkte. Der erste Schritt bei der Verbrennung von Methan ist die Abspaltung eines H-Atoms, wobei ein $\bullet CH_{3}$-Radikal entsteht. Eingeleitet wird dieser Schritt durch andere Radikale wie $\bullet O$ , $\bullet H$ oder $\bullet OH$. Hier sehen Sie eine dieser Startreaktionen:
$CH_{4} +\bullet OH \to \bullet CH_{3} + H_{2}O$
Weiter möchte ich an dieser Stelle nicht auf den Reaktionsmechanismus der Oxidation von Alkanen eingehen.
Halogenierung
Die Halogenierung von Alkanen erfolgt nach dem Mechanismus der Radikalischen Substitution. Den Ablauf dieser Reaktion habe ich in der Abteilung "Reaktionstypen" genauer erläutert; ich muss mich hier nicht wiederholen. Nur ganz kurz eine zusammenfassende Darstellung:
Ein Halogen-Molekül wie $Cl_{2}$ wird durch Lichtenergie in zwei Halogen-Radikale - hier $ \bullet Cl$ - gespalten. Ein Halogen-Radikal setzt sich nun an das Alkan-Molekül und "zieht" ein H-Atom samt Bindungselektron aus dem Alkan heraus. Es bildet sich ein Molekül Halogenwasserstoff, zum Beispiel HCl, und übrig bleibt ein Alkan, dem ein H-Atom fehlt. Das entsprechende C-Atom hat jetzt eine Kugelwolke (oder ein Orbital), das nur mit einem Elektron besetzt ist. Es ist also ein Alkyl-Radikal entstanden. Dieses Alkyl-Radikal ist nun seinerseits sehr reaktiv und entzieht einem neuen Halogen-Molekül ein Halogen-Atom. Es bildet sich ein Molekül des Endprodukts, des Halogen-Alkans. Übrig bleibt wieder ein Halogen-Radikal. Dieses kann nun erneut ein Alkan-Molekül angreifen und diesem ein H-Atom entziehen. Und so geht die Kettenreaktion in die nächste Runde.
Einzelheiten dazu lesen Sie bitte auf der Seite über die Radikalische Substitution nach.
Dehydrierung
Durch den Entzug von Wasserstoff kann man aus Alkanen Vertreter der Stoffklasse der Alkene gewinnen. Das soll hier einmal am Beispiel der Pyrolyse von Pentan gezeigt werden.
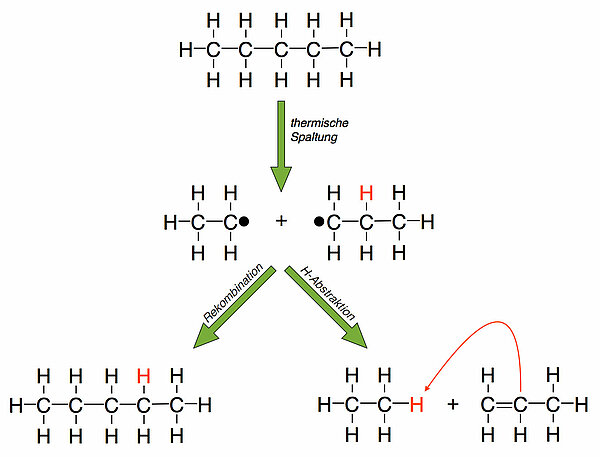
Bei der sogenannten Pyrolyse werden Alkane unter Einwirkung eines Katalysators (Zeolith) erhitzt, dabei bilden sich kürzere Alkylradikale. Solche Alkylradikale haben zwei Möglichkeiten, miteinander zu reagieren. Zunächst einmal kann sich ein neues, größeres Alkan aus zweien dieser Radikale bilden (linker Reaktionsweg). Zum andern kann ein Radikal ein H-Atom homolytisch abspalten und auf das andere Radikal übertragen (Wasserstoff-Abstraktion). So entstehen ein Alkan und ein Alken (rechter Reaktionsweg). Beim thermischen Cracken laufen übrigens ähnliche Prozesse ab: Lange Alkane werden durch hohe Temperaturen in kurze Alkylradikale gespalten, die dann auf die oben gezeigte Weise zu kürzeren Alkanen oder Alkenen reagieren. Natürlich entstehen dabei durch Rekombination von Radikalen auch wieder Moleküle längerer Alkane, aber diese können dann wieder durch die hohe Temperatur in zwei neue Alkylradikale gespalten werden.