Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- Dass tertiäre C-Atome reaktiver sind als sekundäre oder gar primäre,
- dass positive induktive Effekte benachbarter Alkylgruppen die Alkylradikale stabilisieren,
- dass die Stabilität eines Alkylradikals mit der Zahl der benachbarten Alkylgruppen zunimmt,
- welchen Einfluss die Temperatur auf die Bildung von Alkylradikalen hat,
- was man unter Selektivität versteht,
- welchen Einfluss die Art des Halogens auf die Selektivität bei der radikalischen Substitution hat.
C-Atome sind unterschiedlich reaktiv
Auf der Seite für die Stufe EF hatten wir die Bromierung von Propan betrachtet und sind zu dem Schluss gekommen, das man ein Produktgemisch erhalten müsste, in dem hauptsächlich das 1-Brompropan vorkommt, und zwar zu 75%.
Wenn wir den Versuch aber tatsächlich in der Schule durchführen könnten, erhielten wir ein völlig anderes, sehr überraschendes Ergebnis. Statt der erwarteten 75% entstehen vom 1-Brompropan nur lächerliche 1 bis 2%. Das "Nebenprodukt" 2-Brompropan macht mit 98 bis 99% den Hauptanteil aus.
In der Stufe EF konnten wir dieses Ergebnis nur recht oberflächlich erklären: Sekundäre C-Atome geben ihre H-Atome leichter ab als primäre. Im Prinzip ist das schon die korrekte Erklärung, aber in der Stufe Q1 wollen wir der Sache doch etwas näher auf den Grund gehen. Dazu betrachten wir einmal folgende Tabelle (leider weiß ich nicht mehr, in welchen Buch ich diese Daten gefunden habe):
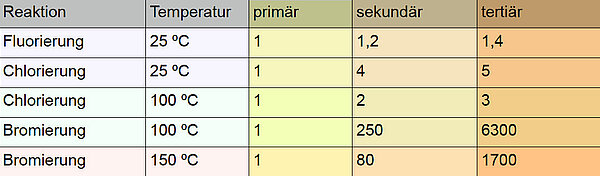
Die Tabelle zeigt die relativen Reaktivitäten primärer, sekundärer und tertiärer C-Atome bei der Halogenierung, und zwar bei 25 ºC, 100 ºC und 150 ºC. Die erste Aufgabe, die Schülern hierzu gestellt wird, lautet:
Aufgabe 1:
Beschreiben Sie, von welchen Faktoren die Reaktivität eines C-Atoms bei der Halogenierung abhängt.
Diese Aufgabe ist recht einfach zu lösen, im Grunde gibt der Aufbau der Tabelle die Antwort schon vor.
Faktor 1: Art des angegriffenen C-AtomsWenn man die drei rechten Spalten vergleicht, kommt man sehr schnell zu der Erkenntnis, dass tertiäre C-Atome reaktiver sind als sekundäre, und diese wiederum reaktiver als primäre. Bei der Chlorierung ist beispielsweise ein tertiäres C-Atom bei 25 ºC fünfmal reaktiver als ein primäres C-Atom. Ein sekundäres C-Atom ist unter diesen Bedingungen immer noch viermal so reaktiv wie ein primäres. Das ist genau der Erkenntnisstand, den wir bereits in der Stufe EF gewonnen hatten.
Faktor 2: Art des HalogensDas Halogen selbst hat einen großen Einfluss auf die Reaktivität. Bei der Bromierung treten die Reaktivitätsunterschiede am stärksten zu Tage. Der Unterschied zwischen tertiären und primären C-Atomen ist bei der Bromierung besonders extrem, 1700 : 1 bei 150 ºC und sogar 6300 : 1 bei 100 ºC. Bei der Chlorierung sind die Unterschiede noch deutlich zu sehen, während sie bei der Fluorierung fast verschwinden.
Faktor 3: TemperaturDie Tempertur ist der dritte Einflussfaktor. Je höher die Temperatur, desto geringer die Reaktivitätsunterschiede.
Weiteres VorgehenNachdem wir nun geklärt haben, von welchen Faktoren die Reaktivität bei der Halogenierung von Alkanen abhängt, wollen wir nun der Frage nachgehen, wieso das jeweils so ist. Wie kann man den Einfluss dieser Faktoren erklären?
Faktor 1: Art des angegriffenen C-Atoms
Tertiäre C-Atome sind am reaktivsten, weil diese C-Atome drei Alkylgruppen besitzen. Jede dieser drei Alkylgruppen übt einen positiven induktiven Effekt auf das tertiäre C-Atom aus. Ein tertäres C-Radikal wird daher von drei Seiten stabilisiert und bildet sich somit am leichtesten.

In dieser Tabelle sehen wir die Bindungsdissoziationsenergien verschiedener C-H-Bindungen. Die Werte sind Mittelwerte aus vier verschiedenen Quellen. Den Ursprung der ersten Quelle kann ich leider nicht mehr feststellen, ein altes Chemiebuch, das ich bereits vor Jahren entsorgt habe. Die zweite Quelle ist die englische Wikipedia, die dritte Quelle das Buch von Fox und Whitesell, und die vierte Quelle das Buch von Cary.
Die englische Wikipedia zeigt in einer Tabelle auf der Seite "Bond dissociation energy" folgende Werte: 439 kJ/mol für CH3-H, 423 kJ/mol für C2H5-H, 414 kJ/mol für (CH3)2CH-H und 404 für (CH3)3C-H.
In dem Buch von Fox und Whitesell gibt es auf Seite 94 andere Werte: 439 kJ/mol für CH3-H, 418 kJ/mol für C2H5-H, 402 kJ/mol für (CH3)2CH-H und 389 für (CH3)3C-H.
In dem Buch von Cary finden sich folgende Werte: 435 kJ/mol für CH3-H, 410 kJ/mol für C2H5-H, 395 kJ/mol für (CH3)2CH-H und 381 für (CH3)3C-H.
Berechnung der Mittelwerte:
- CH3-H = (440 + 439 + 439 + 435) / 4 = 438 kJ/mol
- C2H5-H = (410 + 423 + 418 +410) / 4 = 415 kJ/mol
- (CH3)2CH-H = (396 + 414 + 402 + 395) / 4 = 402 kJ/mol
- (CH3)3C-H = (389 + 404 + 389 + 381) / 4 = 391 kJ/mol
Faktor 2: Art des Halogens
Dieser zweite Faktor ist eigentlich auch recht einfach zu erklären.
Fluor ist bekanntlich eines der reaktivsten Elemente überhaupt. In stark vereinfachter Weise (aber dafür sehr anschaulich) könnte man sich jetzt vorstellen, dass Fluor-Radikale so reaktiv sind, dass sie beim Zusammenstoß mit einem Alkan locker auch primäre H-Atome abtrennen können. Fluor-Radikale unterscheiden kaum zwischen primären, sekundären und tertiären C-Atomen. Man sagt: Fluor-Radikale sind nicht oder kaum selektiv.
Chlor ist schon weniger reaktiv als Fluor. Beim Zusammenstoß mit einem Alkan reicht die Energie des Zusammenstoßes meistens nicht aus, um ein primäres H-Atom abzutrennen. Sekundäre und vor allem tertiäre H-Atome können dagegen wegen des oben beschriebenen +I-Effektes leichter abgetrennt werden. Hier ist die Selektivität schon größer als bei Fluor-Radikalen.
Brom ist am wenigsten reaktiv und am stärksten selektiv von den drei Halogenen. Die meisten Zusammenstöße mit einem Alkan-Molekül sind nicht erfolgreich. Am erfolgreichsten sind noch Zusammenstöße mit einem tertiären C-Atom, weil hier die notwendige Bindungsdissoziationsenergie am ehesten erreicht wird. Erfolgreiche Zusammenstöße mit primären C-Atomen sind aber extrem unwahrscheinlich. Daher ist der Reaktivitätsunterschied und die damit verbundene Selektivität bei der Bromierung am größten.
Faktor 3: Temperatur
Auch den dritten Faktor, den Einfluss der Temperatur, kann man recht leicht erklären. Zunächst einmal hängen die absoluten Reaktionsgeschwindigkeiten von der Temperatur ab, zumindest sollte man das nach der RGT-Regel erwarten.
In der Tabelle finden sich aber keine absoluten Reaktionsgeschwindigkeiten, sondern nur relative. Das sieht man ja, wenn man sich die Spalte mit der Überschrift "primär" anschaut. Hier haben alle Reaktionsgeschwindigkeiten den Wert 1, der auch als 100% interpretiert werden kann. Natürlich läuft die Chlorierung bei 100 ºC um ein Vielfaches schneller ab als die Chlorierung bei 25 ºC. Das ist aber bei der Frage, welche Faktoren die Reaktivität eines C-Atoms beeinflussen, eher eine triviale Nebensache.
Interessant sind die Reaktivitäts-Unterschiede bei den primären, sekundären und tertiären C-Atomen. Bei der Chlorierung ist ein tertiäres C-Atom bei 25 ºC fünfmal so reaktiv wie ein primäres. Bei 100 ºC dagegen ist ein tertiäres C-Atom nur noch dreimal so reaktiv wie ein primäres. Bei der Bromierung ist die Verringerung der Reaktivitäts-Unterschiede mit steigender Temperatur noch deutlicher. Bei 100 ºC sind sekundäre C-Atome 250 mal so reaktiv wie primäre, bei nur 50 ºC mehr (also bei 150 ºC) sind sekundäre C-Atome nur noch 80 mal so reaktiv wie primäre.
Hohe Temperaturen nivellieren also die Reaktivitätsunterschiede bzw. die Selektivität der Halogen-Radikale.
Die Erklärung dafür ist wieder mal recht einfach. Damit eine Reaktion zustande kommt, muss die Aktivierungsenergie überwunden werden. Bildlich stellt man sich die Aktivierungsenergie einer Reaktion immer als eine Art "Berg" dar, der überwunden werden muss. In manchen Fachbüchern ist sogar von einem "Aktivierungsberg" die Rede.
Hat eine Reaktion eine niedrige Aktivierungsenergie, so kann dieser "Berg" bei Zimmertemperatur recht leicht überwunden werden. Ist die Aktivierungsenergie doppelt so hoch, so läuft die Reaktion bei Zimmertemperatur schon deutlich langsamer ab. Durch eine Temperaturerhöhung kann der Aktivierungsberg aber trotzdem überwunden werden, so dass die Reaktionsgeschwindigkeit wieder größer wird.
Bei einer hohen Temperatur spielen die unterschiedlich hohen Aktivierungsberge überhaupt keine Rolle mehr. Die Umgebungsenergie reicht stets aus, jeden auch noch so hohen Aktivierungsberg locker zu überwinden. Eine Selektivität ist so gut wie nicht mehr vorhanden.
Aufgaben
Aufgabe 1
Berechnen Sie die prozentualen Anteile der verschiedenen Mono-Reaktionsprodukte
a) bei der Chlorierung von 2-Methyl-butan bei 100 ºC und
b) bei der Bromierung von 2-Methyl-butan bei 100 ºC.
Halogen-Atome üben bekanntlich einen -I-Effekt auf C-Atome aus.
a) Begründen Sie, warum das so ist.
b) Bei der Bromierung von 2-Methyl-butan entsteht ja auch das Reaktionsprodukt 2-Brom-2-methyl-butan. Dieses Reaktionsprodukt soll nun ein zweites Mal bromiert werden. Erläutern Sie, welche Auswirkungen der -I-Effekt des ersten Brom-Atoms auf die Verteilung der zweifach bromierten Reaktionsprodukte hat.