Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- dass die Energetik einer Reaktion die relative Lage des Übergangszustandes beeinflusst,
- dass bei exothermen Reaktionen der Übergangszustand mehr den Produkten ähnelt, und bei endothermen Reaktionen eher den Edukten,
- dass bei exothermen Reaktionen die Faktoren, welche die Produkte stabilisieren, auch den Übergangszustand stabilisieren.
- dass bei endothermen Reaktionen die Faktoren, welche die Edukte stabilisieren, auch den Übergangszustand stabilisieren.
- dass Brom-Radikale wesentlich selektiver sind als Chlor-Radikale und dass dies an dem Hammond-Effekt liegt.
Die Rolle des Übergangszustandes
Wenn man sich mit der Frage beschäftigt, warum Brom-Radikale wesentlich selektiver sind als Chlor- oder Fluor-Radikale, muss man sich mit dem Hammond-Postulat beschäftigen. Schauen wir uns dazu folgende Skizze an:
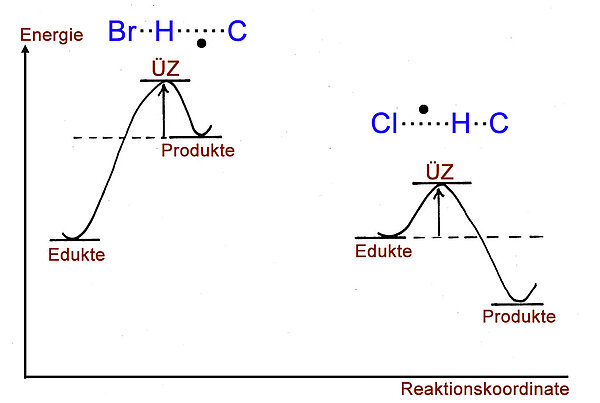
Links sehen wir das Energiediagramm einer Alkan-Bromierung. Genauer gesagt, wird das Energiediagramm des ersten Kettenfortpflanzungsschrittes dargestellt. Das Brom-Radikal ist gerade dabei, ein H-Atom aus dem Alkan zu abstrahieren (zu entfernen). Dieser Schritt ist endotherm, und daher ähnelt der Übergangszustand den Produkten dieses Schrittes. Das zumindest sagt das Hammond-Postulat aus.
Hammond-Postulat
Bei endothermen Reaktionen ähnelt der Übergangszustand den Produkten, bei exothermen Reaktionen den Edukten.
Rechts in der Abbildung sehen wir das Energiediagramm einer Alkan-Chlorierung. Chlor ist wesentlich reaktiver als Brom, das ist der Grund dafür, dass dieser Reaktionsschritt exotherm ist. Nach dem Hammond-Postulat ähnelt der Übergangszustand des ersten Kettenfortpflanzungsschrittes der Bromierung also den Edukten.
Die Chlorierung und Bromierung von Alkanen im Vergleich
Bromierung
Beginnen wir mit der Bromierung. Der Übergangszustand des ersten Kettenfortpflanzungsschrittes ähnelt den Produkten dieses Schrittes. Was sind diese Produkte? Zum einen der Bromwasserstoff, und zum anderen das Alkyl-Radikal.
Vergessen wir den Bromwasserstoff und konzentrieren wir uns auf das Alkyl-Radikal. Der Übergangszustand ähnelt dem Alkyl-Radikal, und alle Faktoren, die einen Einfluss auf die Stabilität des Alkyl-Radikals haben, beeinflussen auch die Stabilität des Übergangszustandes.
Bekanntlich werden tertiäre Alkyl-Radikale leichter gebildet als sekundäre, und diese wiederum leichter als primäre. Das liegt an dem +I-Effekt der benachbarten Alkylgruppen. Mit je mehr Alkylgruppen ein Alkyl-Radikal verbunden ist, desto mehr Elektronendichte wird an das einsame Elektron des Radikals abgegeben, wodurch dieses stabilisiert wird. Tertiäre Radikale sind daher stabiler als sekundäre, und diese wiederum stabiler als primäre.
Auch der Übergangszustand zu einem tertiären Radikal ist bei der Bromierung stabiler als der Übergangszustand zu einem primären Radikal. Darum werden bei der Bromierung im ersten Kettenfortpflanzungsschritt tertiäre H-Atome besonders leicht abgespalten, sekundäre weniger leicht und primäre noch schwerer.
Das Brom-Radikal ist wegen des Hammond-Effekts besonders selektiv, was tertiäre C-Atome bzw. tertiäre H-Atome angeht. Ein tertiäres H-Atom wird bei 100 ºC ca. 6300 mal leichter abgespalten als ein primäres, und ein sekundäres H-Atom immerhin noch 250 mal leichter als ein primäres.
Chlorierung
Das Chlor ist reaktiver als das Brom, der erste Kettenfortpflanzungsschritt verläuft daher exotherm. Das heißt, der Übergangszustand ähnelt den Edukten. Die +I-Effekte, die sich auf die Stabilität des Alkyl-Radikals auswirken, beeinflussen den Reaktionsverlauf längst nicht so stark wie bei der Bromierung, da das Alkyl-Radikal ja kein Edukt ist, sondern ein Produkt dieses Schrittes.
Das Chlor-Radikal ist also wegen des Hammond-Effekts nicht besonders reaktiv, was tertiäre H-Atome angeht. Bei 100 ºC wird ein tertiäres H-Atom nur 3 mal leichter abgespalten als ein primäres, und ein sekundäres nur 2 mal leichter.
Vereinfachte Darstellung des Hammond-Postulats EF, Q1Man kann die vom Fluor zum Chlor zum Brom zunehmende Selektivität des Halogen-Radikals auch ohne Kenntnis des Hammond-Postulats erklären, allerdings vereinfacht das die Sache recht stark. Aber für den Chemieunterricht in der Stufe EF sollte die folgende Erklärung eigentlich ausreichen:
Fluor und Chlor sind derart reaktiv/aggressiv, dass es keine Rolle spielt, ob ein H-Atom an einem primären, sekundären oder tertiären C-Atom sitzt. Die Reaktion ist auf jeden Fall exotherm, und tertiäre C-Atome haben keine "Vorteile" bei der Reaktion.
Brom und Iod sind weniger reaktiv, der erste Kettenfortpflanzungsschritt verläuft meistens endotherm. Hier wirkt es sich günstig aus, wenn sich das Alkylradikal leichter bilden kann, wie es bei tertiären Radikalen der Fall ist.