Propen
Das nächsthöhere Alken nach Ethen ist das Propen, ein Propan-Molekül mit einer C=C-Doppelbindung. Propen ist ein farbloses, brennbares Gas, das man durch thermisches Cracken von Leichtbenzin erhält. Leichtbenzin ist eine der Erdölfraktionen, wird also bei der raffinierten Destillation von Rohöl gewonnen. Die physikalischen Eigenschaften ähneln denen des Propans, die chemischen Eigenschaften allerdings nicht. Genau so wie Ethen neigt auch Propen zur elektrophilen Addition und zur Polymerisation. Weitere Einzelheiten zum Propen siehe entsprechenden Wikipedia-Artikel, die Seite von Thomas Seilnacht oder den Spektrum-Artikel.
Höhere Alkene
Physikalische Eigenschaften
Im Grund haben die Alkene ähnliche physikalische Eigenschaften wie die entsprechenden Alkane. Beide Stoffgruppen haben sehr niedrige Schmelz- und Siedetemperaturen sowie geringe Dichten. Die gemeinsame Ursache hierfür sind die sehr schwachen intermolekularen Bindungen, die ausschließlich durch die van-der-Waals-Kräfte verursacht werden. Sowohl Alkane wie auch Alkene sind nahezu unlöslich in Wasser. Die umgebenden Wasser-Moleküle schließen sich zu größeren Strukturen zusammen, verantwortlich hierfür sind die relativ starken Wasserstoffbrücken-Bindungen zwischen den Wasser-Molekülen. Die Alkan- und Alken-Moleküle können an diesen Strukturen nicht teilhaben und bleiben daher unter sich.
Chemische EigenschaftenDie chemischen Eigenschaften der Alkene ähneln sich: Alle Alkene neigen zur Elektrophilen Addition , zur Radikalischen Addition und zur Polymerbildung, wenn sich ein Alken an ein anderes addiert und sich weitere Alken-Moleküle anlagern. Weitere Einzelheiten siehe den entsprechenden Artikel in der Wikipedia. Weitere empfehlenswerte Webseiten sind die Seite von Lernhelfer, die Seite der Chemgapedia und natürlich der Eintrag im Chemie-Lexikon des Spektrum-Verlages.
Nomenklatur der Alkene
Bei der Benennung der Alkene gelten im Prinzip die gleichen Regeln wie bei der Nomenklatur der Alkane. Ein Alken mit sieben C-Atomen heißt zum Beispiel Hepten. Neu bei den Alkenen ist allerdings das Vorhandensein der Doppelbindung. Bei Ethen und Propen kann die Doppelbindung nur an einer einzigen Position im Molekül vorkommen. Beim Buten gibt es bereits zwei Möglichkeiten, wo sich die C=C-Doppelbindung im Molekül befinden kann, entsprechend gibt es zwei Formen des Butens, 1-Buten bzw. But-1-en und 2-Buten bzw. But-2-en. Von dem But-2-en gibt es dann noch die beiden Formen trans-But-2-en und cis-But-2-en. Außerdem gibt es noch ein viertes Isomer, das 2-Methyl-propen oder Isobuten:
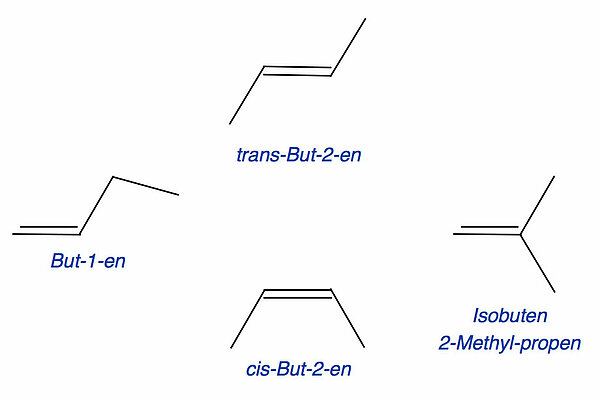
Drei Isomerieformen bei den Butenen
Auf dem Bild sehen wir verschiedene Arten der Isomerie. Zunächst einmal die Konstitutionsisomerie. Die drei Buten links im Bild haben die gleiche Konstitution: Vier C-Atome bilden eine Kette, zwei von diesen vier C-Atomen sind durch eine C=C-Doppelbindung miteinander verbunden. Das Kohlenstoff-Grundgerüst bei diesen drei Butenen ist also gleich. Aus der Reihe fällt das vierte Buten rechts in der Abbildung, das 2-Methyl-propen, auch Isobuten genannt. Die Konstitution von Isobuten könnte so beschrieben werden: "Drei C-Atome bilden eine Kette, zwei von diesen C-Atomen sind durch eine C=C-Doppelbindung verbunden. An dem mittleren C-Atom sitzt außerdem noch ein Methylrest." Eine etwas kürzere Beschreibung der Konstitution wäre diese: "Bei einem Ethen-Molekül sind beide H-Atome eines C-Atoms durch Methylreste ersetzt worden."
Neben der Konstitutionsisomerie finden wir die Valenz- oder Bindungsisomerie. Die Position der C=C-Doppelbindung kann variieren. Beim But-1-en befindet sich die Doppelbindung zwischen den C-Atomen Nr. 1 und 2, und bei den beiden But-2-enen findet sich die Doppelbindung zwischen dem 2. und dem 3. C-Atom.
Eine dritte Isomerieform ist dann die cis/trans-Isomerie, welche die beiden Butene trans-But-2-en und cis-But-2-en unterscheidet. Beim cis-But-2-en befinden sich die beiden Methylgruppen auf der gleichen Seite der Doppelbindung, bei dem trans-But-2-en auf gegenüberliegenden Seiten.
Vertiefung
Im Lexikon-Artikel "Butene" finden Sie Informationen über die physikalischen Eigenschaften der vier verschiedenen Buten-Isomere sowie einen Abschnitt über Bedeutung und Verwendung der Butene.
Zur cis/trans-IsomerieInteressant ist die cis/trans-Isomerie, sie wirkt sich auf die physikalischen Eigenschaften der Alkene aus. Grundsätzlich haben die cis-Isomere ein größeres Dipolmoment als die trans-Isomere. Das liegt am +I-Effekt der an der Doppelbindung hängenden Alkylgruppen. Liegen beide Alkylgruppen auf der gleichen Seite der Doppelbindung (cis-), dann addieren sich die Dipolmomente der beiden Alkylgruppen. Liegen sie sich jedoch gegenüber (trans-), dann heben sich die Dipolmomente mehr oder weniger auf. Daher haben cis-Alkene allgemein höhere Siede- und Schmelztemperaturen als ihre trans-Isomere (siehe Butene).
Für Schüler mit den Fach Ernährungslehre:
Bei unsgesättigten Fettsäuren spielt die cis/trans-Isomerie eine wichtige Rolle. Fettsäuren sind Carbonsäuren mit mindestens vier C-Atomen. Ungesättigte Fettsäuren haben mindestens eine C=C-Doppelbindung im Molekül. Bei natürlich vorkommenden Fettsäuren liegen diese Doppelbindungen in der Regel in der cis-Variante vor. Dadurch entsteht ein deutlicher Knick im Fettsäure-Molekül, die veränderte Struktur hat auch veränderte Eigenschaften zur Folge: Fette mit ungesättigten Fettsäuren schmelzen eher. Bei bestimmten Prozessen der Nahrungszubereitung wandeln sich diese cis-Doppelbindungen in trans-Doppelbindungen um, es entstehen dann die ungesunden trans-Fettsäuren. Vor allem beim Frittieren oder beim Braten mit hohen Temperaturen bilden sich diese trans-Fettsäuren.
Für Experten Q2
Wer sich über die cis/trans-Isomerie näher informieren möchte, kann sich den Lexikon-Artikel "cis/trans-Isomerie" anschauen. Für Leute, denen das immer noch nicht reicht, gibt es die Spezialseite zur cis/trans-Isomerie. Auf dieser Seite wird auch auf das etwas komplexere Thema E/Z-Isomerie eingegangen. Das ist aber nur für Schüler der Stufe Q2 oder für Studenten im Chemie-Grundstudium interessant.
Nomenklatur verzweigter Alkene
Genau wie bei den Alkanen gibt es auch verzweigte Alkene; das Isobuten haben wir eben ja bereits kennengelernt, es ist das einfachste verzweigte Alken. Schauen wir uns nun einmal zwei verzweigte Heptene an:
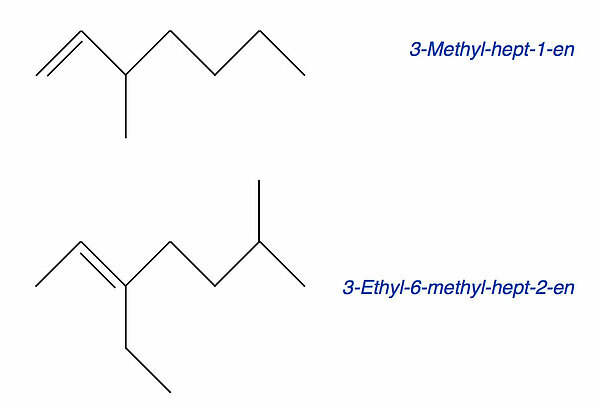
Das obere Alken ist ein Hepten, das als 3-Methyl-hept-1-en bezeichnet wird. Die längste durchgehende Kohlenstoffkette beseht aus sieben C-Atomen, daher handelt es sich um ein Hepten. Die C=C-Doppelbindung befindet sich zwischen dem 1. und dem 2. C-Atom, also liegt ein Hept-1-en vor. Am 3. C-Atom sitzt ein Methyl-Rest, daher haben wir es hier mit dem 3-Methyl-hept-1-en zu tun.
Auf analoge Weise kommt man bei dem unteren Alken zu dem Namen 3-Ethl-6-methyl-hept-2-en. Die Doppelbindung hat Vorrang bei der Namensgebung, daher kommt der Name 5-Ethyl-2-methyl-hept-5-en nicht in Frage; die Position der Doppelbindung muss immer eine möglichst keine Ziffer bekommen.
Betrachten wir nun ein weiteres Alken:
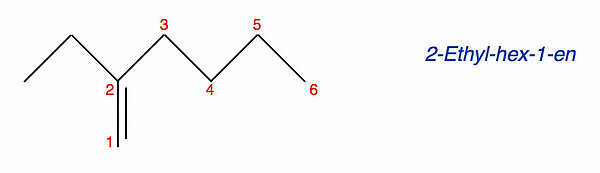
Wenn man hier die längste durchgehende Kohlenstoffkette sucht, kommt man auf sieben C-Atome. Trotzdem ist der Stammname dieser Verbindung nicht "-hepten", sondern "-hexen". Wie kann man das erklären?
Bei verzweigten Alkenen gilt die Regel, dass die Kohlenstoffkette Priorität hat, in der die C=C-Doppelbindung vorkommt, auch wenn sie kürzer ist als die längste Kohlenstoffkette im Molekül. Genau das ist beim oberen Beispiel der Fall. Die Verbindung hat den Namen 2-Ethyl-hex-1-en.