Die van-der-Waals-Kräfte oder -Wechselwirkungen sind die schwächsten der schwachen chemischen Bindungen.
Zur Erinnerung: Schwache chemische Bindungen sind die van-der-Waals-Kräfte, die Dipol-Dipol-Kräfte und die H-Brücken. Starke chemische Bindungen dagegen sind die Ionenbindung, die metallische Bindung und natürlich die kovalente Bindung bzw. Elektronenpaarbindung.
Schauen wir uns ein Wasserstoff-Molekül an:
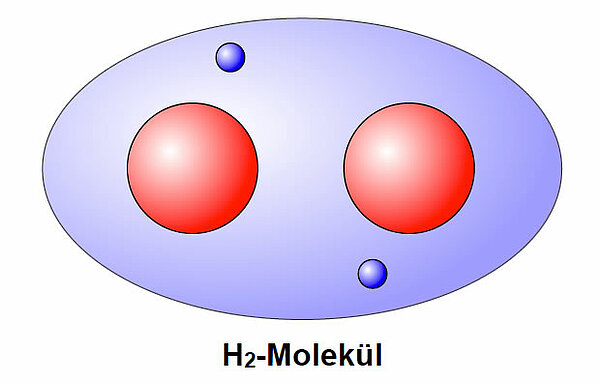
Die beiden Bindungselektronen der gemeinsamen Kugelwolke halten sich zur Zeit der "Aufnahme" ungefähr in der Mitte der Kugelwolke auf. Die beiden negativen Ladungen sind mehr oder weniger gleichmäßig verteilt, die Bindung ist unpolar.
Machen wir eine neue "Aufnahme", ein paar millionstel Sekunden nach der ersten "Aufnahme":
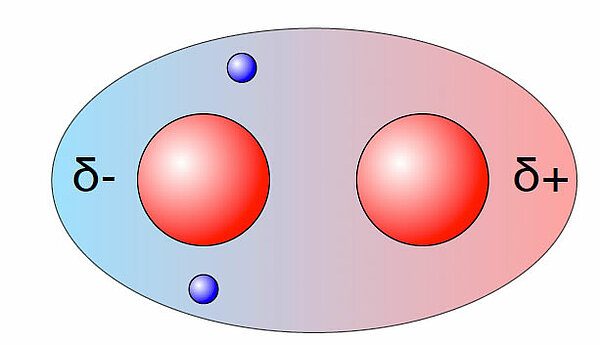
Zufällig befinden sich beide Elektronen in der "linken" Hälfte der Kugelwolke. Die rechte Hälfte ist leer. Durch diese Anordnung der beiden Elektronen bildet sich für extrem kurze Zeit ein Dipol, ein temporärer Dipol.
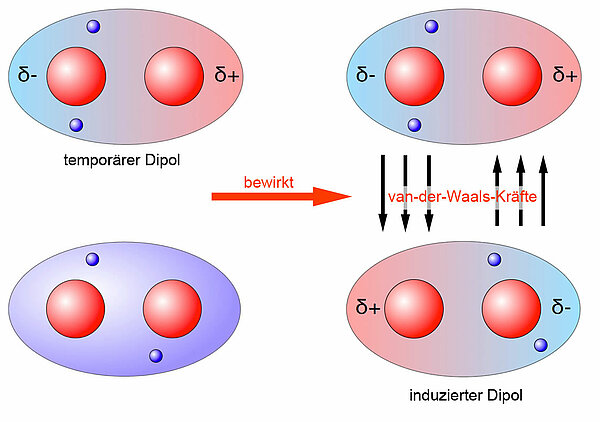
Wie das obere Bild sehr schön zeigt, bewirkt ein solcher temporärer Dipol, dass die Elektronen eines anderen Wasserstoff-Moleküls abgestoßen (in der "linken" Hälfte der Kugelwolke) bzw. angezogen werden (in der "rechten" Hälfte der Kugelwolke). Es entsteht ein induzierter Dipol mit entgegengesetzten Vorzeichen. Der temporäre Dipol, der diese Veränderung bewirkt hat, und der entstandene induzierte Dipol ziehen sich für extrem kurze Zeit gegenseitig an. Ein paar millionstel Sekunden sieht die Sache schon wieder ganz anders aus, weil sich die Elektronen in den Kugelwolken mit extrem hoher Geschwindigkeit bewegen. Diese temporären Dipolkräfte sind aber dafür verantwortlich, dass unpolare Verbindungen wie Wasserstoff, Methan, Hexan und so weiter überhaupt mal flüssig oder sogar fest werden können. Gäbe es diese van-der-Waals-Kräfte nicht, so wären diese Verbindungen selbst bei den tiefsten Temperaturen gasförmig und nicht wie beispielsweise Hexan bei Zimmertemperatur flüssig. Oder denken Sie an das Element Iod, das ebenfalls aus völlig unpolaren Molekülen besteht. Es ist bei Zimmertemperatur sogar fest - dank der van-der-Waals-Bindungen zwischen den Iod-Molekülen.
Neuere Erkenntnisse zu den van-der-Waals-Kräften
In der Wikipedia und in moderneren Chemie-Büchern werden die van-der-Waals-Kräfte in drei Bestandteile zerlegt:
Keesom-Wechselwirkung = Wechselwirkungen zwischen zwei Dipolen (Dipol-Dipol-Kräfte)
Debye-Wechselwirkung = Wechselwirkung zwischen einem Dipol und einem polarisierbaren Molekül, das selbst aber kein Dipol ist. Ein gutes Beispiel ist hier das Brom-Molekül Br2, das leicht zu einem temporären Dipol umgewandelt werden kann, wenn ein nucleophiles oder elektrophiles Teilchen in der Nähe ist, wie es beispielsweise bei der Bromierung eines Alkens der Fall ist.
London-Kräfte = Wechselwirkung zwischen zwei polarisierbaren Molekülen, die selbst keine Dipole sind. Diese schwächsten aller Wechselwirkungen werden auch als van-der-Waals-Kräfte im engeren Sinne.