Auswirkungen der Doppelbindung
Bei der Besprechung der Strukturdaten des Ethens hatten wir gesehen, dass die C=C-Doppelbindung aus zwei verschiedenen Bindungstypen besteht. Einmal ist da die stabile Sigma-Bindung, welche durch die Überlappung von zwei sp2-Hybridorbitalen zustande kommt. Es sind 450 kJ/mol notwendig, um diese Bindung zu spalten. Zum andern ist da die nicht so stabile pi-Bindung, welche durch die Überlappung der beiden pz-Orbitale der Kohlenstoff-Atome entsteht. Um diese Bindung zu spalten, sind nur 270 kJ/mol erforderlich.
Beide Bindungen zusammen führen dazu, dass
- die C=C-Doppelbindung kürzer ist als die C-C-Einfachbindung,
- die C=C-Doppelbindung elektronenreicher ist als die Einfachbindung,
- die C=C-Doppelbindung die freie Drehbarkeit um die C-C-Achse verhindert. werden, in unpolaren Lösemitteln ist Ethen dagegen sehr gut löslich ("Gleiches löst Gleiches"). Ethen hat ähnliche physikalische Eigenschaften wie Ethan, das liegt hauptsächlich daran, dass auch die Ethen-Moleküle nur sehr schwache intermolekulare Anziehungskräfte besitzen.
Eine neue Form der Isomerie
Das Aufheben der freien Drehbarkeit bei Alkenen hat eine wichtige Konsequenz. Bei den 2-Butenen gibt zwei verschiedene Isomere, die sich in ihren physikalischen Eigenschaften deutlich unterscheiden, nämlich das cis-But-2-en und das trans-But-2-en.
Beim cis-But-2-en liegen die beiden Methylgruppen auf der gleichen Seite der Doppelbindung, bei trans-But-2-en liegen sich die beiden Methylgruppen gegenüber.
Nun denken Sie vielleicht, dass sich die beiden Isomere nicht wesentlich voneinander unterscheiden. Schauen wir uns dazu einmal die Schmelz- und Siedetemperaturen der beiden Verbindungen an:
| Eigenschaft | cis-But-2-en | trans-But-2-en |
|---|---|---|
| Schmelzpunkt | -139 ºC | -106 ºC |
| Siedepunkt | 4 ºC | 1 ºC |
Es ist ganz offensichtlich, dass die cis-trans-Isomerie Auswirkungen auf die Eigenschaften der Verbindungen hat.
Den höheren Siedepunkt des cis-Butens kann man leicht erklären. Die Methylgruppen haben einen positiven induktiven Effekt, sie "schieben" also Bindungselektronen in Richtung auf die beiden mittleren C-Atome. Dadurch entstehen schwache Dipol-Kräfte, die sich beim cis-Buten addieren, während sie sich beim trans-Buten gegenseitig aufheben.
Den niedrigeren Schmelzpunkt des cis-Butens kann man mit diesem Dipol-Effekt allerdings nicht erklären. Beim Schmelzen müssen die Anziehungskräfte überwunden werden, mit denen die Buten-Moleküle im Buten-Kristall zusammengehalten werden. Offensichtlich kann man das trans-Buten besser "stapeln", so dass die Moleküle im Kristall dichter beeinander sitzen. Entsprechend sind die Anziehungskräfte höher. Das cis-Buten kann im festen Zustand nicht so eng "gestapelt" werden, die Abstände zwischen den Molekülen sind größer, und daher sind die Anziehungskräfte kleiner, was wiederum einen niedrigeren Schmelzpunkt zur Folge hat.
Von besonderem Interesse ist die cis-trans-Isomerie bei den ungesättigten Fettsäuren. Siehe hierzu die Seite über trans-Fettsäuren in meiner Biologie-Abteilung.
Für Experten
Die Begriffe cis-Isomer und trans-Isomer sind nicht immer eindeutig; aber sie werden trotzdem in den meisten Büchern noch für die einfacheren Fälle verwendet. Eindeutiger ist es, von Z- und E-Isomeren zu sprechen. Dabei sind Z-Isomere weitgehend mit cis-Isomeren identisch (Z steht für "zusammen", also auf der gleichen Seite), während E-Isomere weitgehend mit trans-Isomeren identisch sind (E steht für "entfernt", also auf der anderen Seite).
Allerdings ist diese Übereinstimmung Z = cis und E = trans nicht immer richtig, es gibt Ausnahmen. In der Alken-Seite der Chemgapedia wurde ein sehr schönes Beispiel behandelt:

Die linke Verbindung heißt cis-Brom-dichlor-ethen, nach der Z/E-Schreibweise aber E-Brom-dichlor-ethen. Das liegt daran, dass bei der Z/E-Schreibweise auf die Rangordnung der Substitutenten geachtet wird. So hat Chlor eine höhere Priorität (Rangordnung) als Wasserstoff, aber eine niedrigere Priorität gegenüber Brom. Es gilt also Br > Cl > H.
Das folgende Bild macht diesen Sachverhalt deutlich:
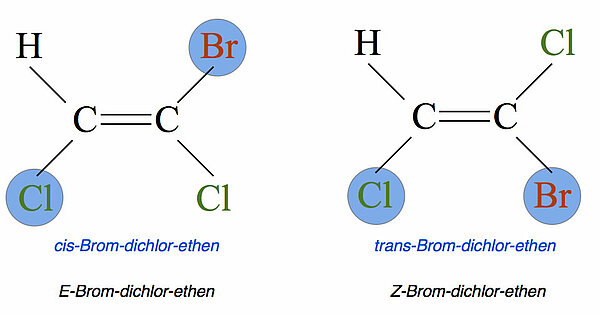
Für jede Seite der Doppelbindung (in der Abbildung also "links" und "rechts") wird zunächst der Substitutent mit der höchsten Rangordnung bestimmt. Auf der "linken Seite" des linken Moleküls hat das Chlor die höchste Rangordnung (Cl > H). Auf der rechten Seite aber hat das Brom die höchste Rangordnung (Br > Cl). Also liegen sich die Substituenten mit der höchsten Rangordnung gegenüber, daher die Bezeichnung "E" (wie "entfernt").
Beim rechten Molekül werden wieder für die linke und die rechte Seite der C=C-Doppelbindung die höchstwertigen Substituenten bestimmt. Diesmal liegen diese auf der gleichen Seite der Doppelbindung, im Bild also "unten". Das rechtfertigt die Bezeichnung "Z" (wie "zusammen").