Wenn ein Aktionspotenzial das Endknöpfchen erreicht, öffnen sich spannungsgesteuerte Calciumkanäle, durch die Calciumionen in das Endknöpfchen eindringen.
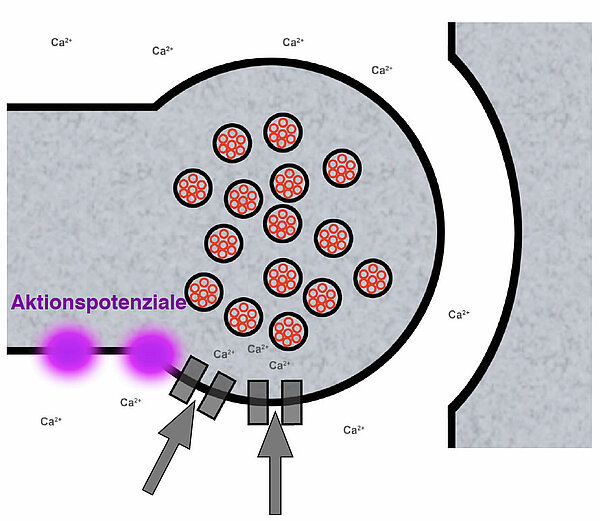
Die Calciumionen-Konzentration im Außenmedium der Synapse ist bedeutend höher als im Zellinnern, die Ionen strömen also mit dem Konzentrationsgradienten in die Zelle hinein. Außerdem werden sie von der negativen Ladung der Membraninnenseite regelrecht angezogen.

Die Ca2+-Ionen bewirken, dass sich die synaptischen Vesikel in
Richtung präsynaptische Membran bewegen. Nach einer gängigen Modellvorstellung setzen sich die Calcium-Ionen an bestimmte Proteinfasern, die das synaptische Endknöpfchen durchziehen. Dabei handelt es sich um Transportproteine, die mit den synaptischen Vesikeln verbunden sind. Wenn sich die Calcium-Ionen an diese Proteine setzen, kontrahieren die Fasern und schleppen die synaptischen Vesikel "als Gepäck" mit in Richtung synaptischen Spalt.
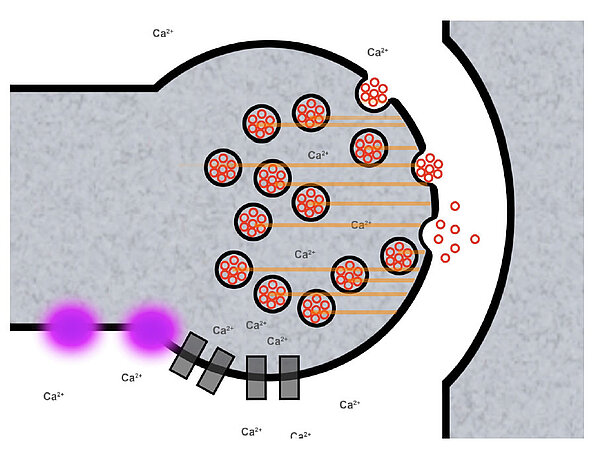
Die synaptischen Vesikel fusionieren (verschmelzen) mit der präsynaptischen Membran, so dass die Neurotransmitter in den synaptischen Spalt gelangen. Auch bei diesem Schritt spielen die
Ca2+-Ionen eine wichtige Rolle.
Eine recht hilfreiche Vorstellung zum Verständnis dieser Membranfusion ist es, wenn man an Fettaugen denkt, die auf der Suppe schwimmen. Wenn sich zwei solcher Fettaugen berühren, verschmelzen (fusionieren) sie zu einem großen Fettauge. So ähnlich muss man sich auch die Fusion der synpatischen Vesikel mit der präsynaptischen Membran vorstellen.
Für die Aufklärung dieses Fusionsmechanismus gab es im Oktober 2013 den Nobelpreis für Medizin.
Wie jüngste Forschungen zeigen, wird die Neurotransmitter-Freisetzung durch so genannte CAPS-Proteine geregelt. Unterdrückt man bei Mäusen die Synthese dieser CAPS-Proteine gentechnisch (Ausschalten der entsprechenden Gene), so können die Nervenzellen dieser Mäuse zwar noch arbeiten, aber die Zellen haben erhebliche Probleme, auf schnell wechselnde Signale mit Neurotransmitter-Ausschüttung zu reagieren. Quelle: Spektrum direkt vom 15.11.2007.