Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- Wieso die Fluorierung von Alkanen oft zu Kettenbrüchen im Alkan führt,
- wieso die Iodierung von Alkanen meistens nicht funktioniert,
- was der Unterschied zwischen kinetischer und thermodynamischer Kontrolle ist.
Reaktivität und Selektivität
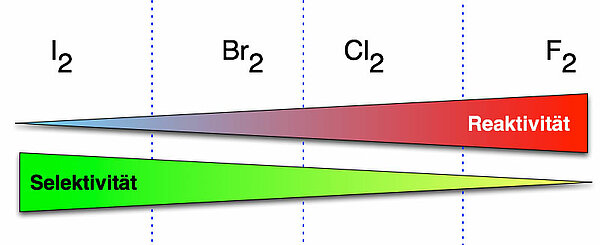
Die Abbildung zeigt noch einmal deutlich den Zusammenhang zwischen Reaktivität und Selektivität bei den vier Halogenen Iod, Brom, Chlor und Fluor.
Fluor ist am reaktivsten von allen vier Halogenen, die Halogenierung eines Alkans verläuft daher sehr exotherm. Das ist auch bei der Chlorierung und der Bromierung der Fall. Die Iodierung ist in der Regel schon endotherm und findet daher meistens gar nicht statt.
Umgekehrt ist es bei der Selektivität. Theoretisch hätte Iod die größte Selektivität, wenn die Reaktion ablaufen würde, was sie meistens nicht tut. Brom ist von den drei reaktiven Halogenen das selektivste und wird daher meistens verwendet, wenn man ein ganz bestimmtes Halogenalkan herstellen möchte, ohne viele Nebenprodukte. Die Selektivität von Chlor ist schon stark abgeschwächt, und bei Fluor braucht man von Selektivität gar nicht erst zu reden.
Fluorierung
Die Fluorierung eines Alkans ist grundsätzlich möglich. Beide Kettenfortpflanzungsschritte sind sogar exotherm. Beim ersten Kettenfortpflanzungsschritt werden 163 kJ/mol freigesetzt, beim zweiten Kettenfortpflanzungsschritt sogar 388 kJ [1]. Daher ist eine Fluorierung äußerst gefährlich, es kann zu Überhitzungen oder sogar zu Explosionen kommen.
Aus diesen Gründen führt man eine Fluorierung meistens nicht mit elementarem Fluor durch, sondern man nimmt spezielle Fluor-Verbindungen. Der Römpp listet hier Alkalifluoride, Cobalt(III)-fluorid, Halogenfluoride, Antimonfluoride, Molybdänfluoride, Fluorwasserstoff, Xenonfluoride, und Schwefeltetrafluorid auf [2]. Als typische Reaktion wird hier die Swarts-Reaktion genannt, die in der Wikipedia gut beschrieben ist [3].
Das Ergebnis einer Fluorierung sind dann Fluoralkane, die aber keine so besonders große Bedeutung haben. Wichtiger sind die Fluorchlor-Kohlenwasserstoffe, kurz FCKWs, die man durch Fluorierung von Chlor-Alkanen mit Fluorwasserstoff erhält.
$CHCl_{3} + 2 \ HF \to CHClF_{2} + 2 HCl$
Hier sehen wir eine solche Reaktion [4].
Aufgabe
Für diese Aufgabe benötigen Sie die beiden Tabellen mit den Bindungsdissoziationsenergien.
Die Energiebilanz für die Hexan-Fluorierung hatten Sie ja bereits in Aufgabe 3 auf der Seite über die Kettenreaktion berechnet.
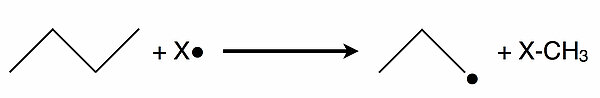
Bei der Fluorierung kann es passieren, dass auch C-C-Einfachbindungen vom Fluor-Radikal angegriffen werden.
- Betrachten Sie die Abbildung 2 und berechnen Sie dann die Reaktionsenthalphie dieses Schrittes. X ist dann Fluor.
- Vergleichen Sie nun diese Reaktionsenthalpie mit der Energie, die umgesetzt wird, wenn das Fluor-Radikal sich mit einem sekundären H-Atom des Butan-Moleküls verbinden würde.
- Begründen Sie dann, wieso bei der Fluorierung von Alkanen die Kohlenstoffketten der Alkane oft gespalten werden.
Iodierung
Die Iodierung eines Alkans ist ebenfalls grundsätzlich möglich. Allerdings verlaufen die meisten Iodierungen endotherm. Für die beiden Kettenfortpflanzungsschritte werden 29 kJ/mol verbraucht [1].
Hoher EnergiebedarfDiese hohe Energiebedarf liegt nicht an der Spaltung des Iod-Moleküls. In Iod-Atom aus einem Iod-Molekül abzutrennen kostet sogar weniger Energie als die Abtrennung eines Brom-Atoms aus einem Brom-Molekül. Das größte Problem bei der Iodierung ist die Bildung des Iodwasserstoffs. Der Energiegewinn bei der HBr-Bildung beträgt nur 295 kJ/mol, das ist sehr wenig [6].
Iod als InhibitorIod reagiert nicht nur nicht mit Alkanen, sondern wirkt im Gegenteil auch noch als Inhibitor (Hemmstoff). Ein Alkylradikal kann nämlich durchaus mit einem Iod-Molekül reagieren. Es entsteht dann ein Iodalkan-Molekül und ein Iod-Radikal. Nur kann dieses Iod-Radikal die Kettenreaktion nicht fortsetzen, weil der nächste Kettenfortpflanzungsschritt endotherm wäre.
Alternative WegeMöchte man ein bestimmtes Iodalkan synthetisieren, beschreitet man meistens andere Wege, zum Beispiel über die Substitution eines Chloralkans mit Iodid-Ionen (Finkelstein-Reaktion) oder die Addition von Iod I2 oder Iodwasserstoffe HI an ein Alken.
Finkelstein-Reaktion
Hierbei handelt es sich um eine normale nucleophile Substitution.
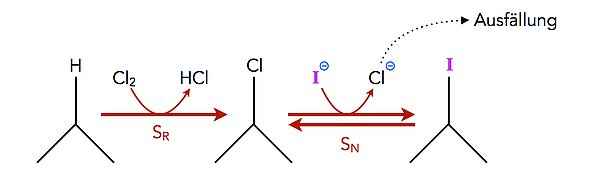
An einem Chloralkan wird das Chlor-Atom durch ein Iod-Atom ersetzt. Als Nucleophil setzt man dazu Natriumiodid ein, das in Aceton gelöst wurde. Die Reaktion verläuft nach einem SN2-Mechanismus, das Iod "schiebt" das Chlor quasi aus dem Chloralkan heraus. Um die Gleichgewichtslage der Reaktion auf die Produktseite zu verschieben, fällt man das entstandene Chlorid aus, so dass dessen Konzentration stets gering gehalten wird (Prinzip des kleinsten Zwangs) [5].
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.
- Wikipedia, Artikel "Swarts-Reaktion"
- Wikipedia, Artikel "Fluorchlorkohlenwasserstoffe"
- Wikipedia, Artikel "Finkelstein-Reaktion"
- Organikum, 22. Auflage, Weinheim 2004.