Ein kleiner Versuch
In dem aktuellen Schroedel-Buch "Chemie heute, Qualifikationsphase NRW" von 2014 steht auf Seite 144 ein schöner kleiner Versuch, der sich hervorragend für eine Einführungsstunde in das Thema "elektrophile Substitution" eignet. Vor einigen Tagen (Stand: Oktober 2018) habe ich diesen Versuch mit meinem Chemie GK als Schülerversuch im Abzug durchgeführt. Allerdings hatten meine Schüler(innen) Schwierigkeiten, eine Reaktion zu beobachten, vor allem die Sache mit dem Indikatorpapier hat nicht funktioniert. Daher habe ich anschließend den Versuch als Demonstrationsversuch mit deutlich größeren Mengen an Edukten durchgeführt.

Die elektrophile Substitution: Bildung des π-Komplexes
Wir haben den Versuch zwar mit Toluol durchgeführt, aber im Folgenden soll er am Beispiel des einfacheren Benzols erklärt werden. An sich hätten wir bei dem Versuch ja Benzol verwendet, aber leider ist das für den Schulunterricht verboten; Toluol ist der offizielle Ersatzstoff für Benzol.
Das aromatische System des Benzols ist wegen der sechs delokalisierten π-Elektronen ein Angriffsziel für elektrophile Teilchen. Br2-Moleküle sind allerdings nicht elektrophil, da es sich um unpolare Teilchen handelt. Damit Br2-Moleküle mit Benzol reagieren können, müssen sie erst polarisiert werden.
Rückblick: Die elektrophile Addition von Brom an ein AlkenBei der Bromierung von Alkenen nach dem Mechanismus der elektrophilen Addition ist es die C=C-Doppelbindung selbst, die das Brom-Molekül polarisiert. Zunächst bildet sich ein lockerer pi-Komplex aus der Doppelbindung und dem polarisierten Brom-Molekül, der dann in einen etwas festeren Sigma-Komplex übergeht, nachdem das Brom-Molekül heterolytisch in ein Brom-Kation und ein Bromid-Anion gespalten wurde.
Polarisierung des Brom-Moleküls bei der elektrophilen SubstitutionDie sechs π-Elektronen des Benzols sind nicht in der Lage, das Brom-Molekül ausreichend zu polarisieren. Erst mit Hilfe eines Katalysators gelingt die Polarisierung des Brom-Moleküls. Theoretisch sollte sich Aluminiumbromid AlBr3 oder Aluminiumchlorid AlCl3 gut dafür eignen. Aluminiumchlorid ist eine Lewis-Säure, das Al-Atom besitzt eine leere Kugelwolke bzw. ein leeres Orbital und kann daher mit einer Lewis-Base reagieren. Allerdings hat der Schulversuch mit Aluminium nicht funktioniert, mit Eisen dagegen sehr gut.
Gibt man in die organische, bromhaltige Phase etwas Eisenpulver, so reagiert dieses mit dem vorhandenen Brom zu Eisenbromid FeBr3. Auch das Eisen-Atom hat eine leere Kugelwolke bzw. ein leeres Orbital. Eisenbromid ist daher eine Lewis-Säure.
Das Brom-Moleküle besitzt sechs freie Elektronenpaare bzw. doppelt besetzte Orbitale und ist daher eine Lewis-Base. Es kann also folgende Reaktion stattfinden:
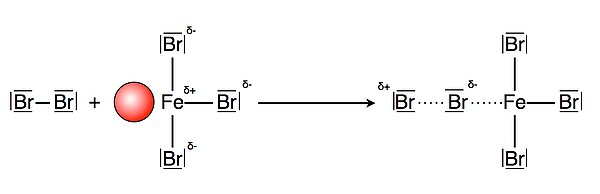
Die Abbildung 2 zeigt den Vorgang der Polarisierung des Brom-Moleküls durch das Eisenbromid. Nun ist das Brom-Molekül elektrophil genug, um mit seinem positiv polarisierten Ende die pi-Elektronen des Benzolrings angreifen zu können:
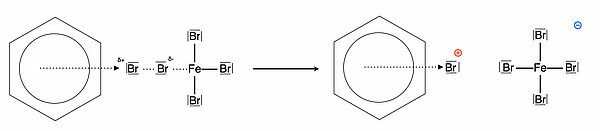
In der Abbildung 3 sehen wir die Bildung des π-Komplexes (sprich: pi-Komplex). Das bereits polarisierte Brom-Molekül wird dabei heterolytisch gespalten. Dabei spielen sowohl der Katalysator Eisenbromid wie auch die pi-Elektronen des Benzols eine wichtige Rolle. Das gebildete Brom-Kation setzt sich dann als Elektrophil in die pi-Elektronenwolke des Benzols. In der Graphik wird diese lockere Bindung durch einen gestrichelten Pfeil angedeutet. Das entstandene Brom-Anion verbindet sich kovalent mit dem Eisenbromid, dabei bildet sich der FeBr4- - Komplex.
Wichtig ist hier, dass der aromatische Charakter des Benzol-Rings noch besteht. Alle sechs C-Atome des Benzolrings sind sp2-hybridisiert.
Der π-Komplex ist - zumindest bei der Benzolbromierung - ein instabiler Übergangszustand, der nicht isoliert werden kann. Es gibt allerdings sehr starke Elektrophile wie beispielsweise das Nitrosyl-Kation, die einen relativ stabilen π-Komplex bilden können.
Bildung des σ-Komplexes
Im nächsten Schritt verbindet sich das Brom-Kation mit einem der sechs C-Atome des Benzols. Dabei entsteht eine kovalente Bindung zwischen dem C-Atom und dem Br-Atom, während die positive Ladung des Brom-Kations über den ganzen Benzolring "verteilt" wird.
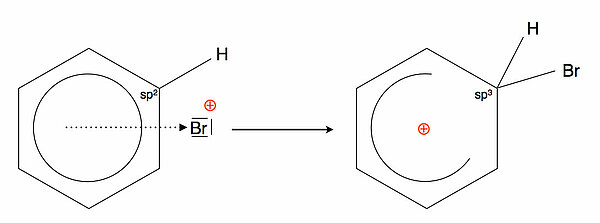
Wenn das C-Atom (in der Abbildung rechts oben) eine Verbindung mit dem Brom-Atom eingeht, ändert es seinen Hybridisierungszustand: Aus dem sp2-Atom wird ein sp3-Atom.
Durch diesen Hybridisierungswechsel verliert das C-Atom sein pz-Orbital, und der Ring aus sechs pz-Orbitalen, der ja für den aromatischen Zustand des Benzols verantwortlich war, ist unterbrochen. Damit wird der aromatische Zustand des Benzolringes komplett aufgehoben.
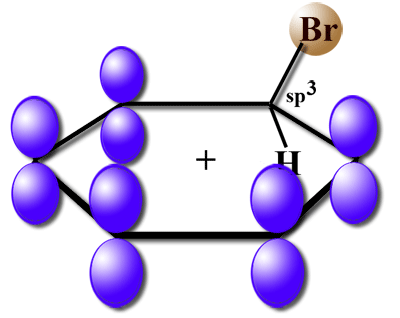
Hier eine etwas ältere Abbildung des sigma-Komplexes, in der man die p-Orbitale des Benzolrings gut sehen kann:
Auf dem Weg zum Produkt
Wie läuft die Reaktion nun weiter? Der jetzt herrschende Zustand ist energetisch ungünstig, da
a) der aromatische Charakter des Benzols nicht mehr besteht und
b) die delokalisierte positiven Ladung das Ringsystem stört.
Es gibt nun zwei Möglichkeiten, wie wieder ein energetisch günstiger Zustand hergestellt werden könnte. Betrachten wir dazu das folgende Energiediagramm:
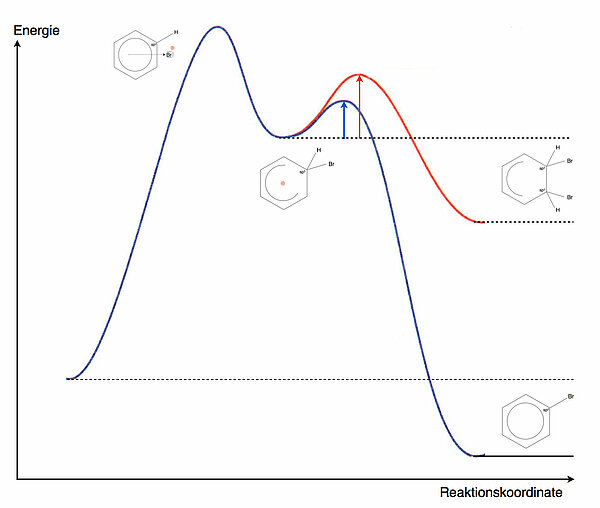
Reaktionsweg 1: Addition eines Nucleophils
Die delokalisierte positive Ladung im Benzolring zieht nucleophile Teilchen an, zum Beispiel Bromid-Ionen, Hydroxid-Ionen etc. Ein solches Nucleophil könnte sich nun an ein anderes C-Atom des Benzolrings anlagern und dabei die positive Ladung übernehmen. Im Falle der Addition eines Bromid-Ions würde ein Dibrom-Cyclohexadien entstehen.
Vorteil: Die energetisch ungünstige positive Ladung wird neutralisiert.
Nachteil 1: Das sp3-hybridisierte C-Atom des sigma-Komplexes bleibt sp3-hybridisiert.
Nachteil 2: Das sp2-hybridisierte C-Atom, an das sich das Nucleophil anlagert, wird ebenfalls sp3-hybridisiert.
Der aromatische Zustand des Benzols würde bei diesem Reaktionsweg, der nichts anderes ist als eine elektrophile Addition, endgültig verloren gehen. Eine elektrophile Addition an den Benzolring ist theoretisch möglich, aber energetisch sehr ungünstig.
Das Reaktionsprodukt hätte eine deutlich höhere Energie als die Ausgangsstoffe, und entsprechend hoch wäre die Aktivierungsenergie für diesen Teilschritt. Die Geschwindigkeit einer Reaktion hängt wiederum von der Aktivierungsenergie ab, so dass die Wahrscheinlichkeit für diesen Reaktionsschritt sehr gering wäre.
Reaktionsweg 2: Abgabe eines ProtonsSpielen wir nun einen anderen Reaktionsweg durch. Dasjenige C-Atom des Benzolringes, das das Br-Atom aufgenommen hat, ist im Sigma-Komplex sp3-hybridisiert. Es ist immer noch mit dem Br-Atom und dem "alten" H-Atom verbunden.
Wenn dieses sp3-hybridisierte C-Atom nun sein H-Atom als Proton H+ abgibt und damit die beiden Bindungselektronen behält (heterolytische Spaltung), ändert es dabei seinen Zustand wieder zurück zu sp2. Damit sind alle sechs C-Atome des Benzolrings sp2-hybridisiert, und die sechs pz-Orbitale bilden wieder einen geschlossenen Ring, in dem sich sechs Elektronen aufhalten können. Mit anderen Worten: Der energetisch günstige aromatische Zustand hat sich zurück gebildet.
Der Energieverlauf dieses Reaktionsweges sieht sehr viel günstiger aus, vor allem ist hier die Reaktion exotherm, und die Aktivierungsenergie für den zweiten Reaktionsschritt ist recht gering. Also ist diese Reaktion sowohl thermodynamisch (exotherme Reaktion) wie auch kinetisch (geringere Aktivierungsenergie) gegenüber der Addition bevorzugt.
Betrachten wir beide Reaktionswege noch einmal in einer Skizze:
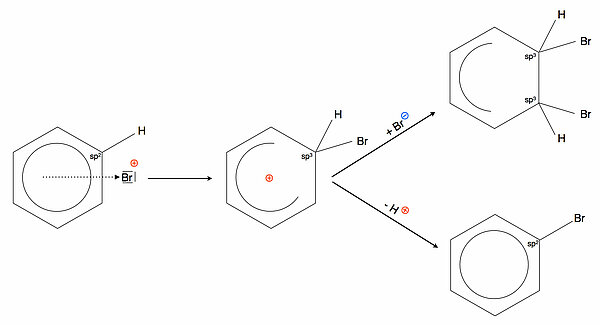
Rückbildung des Katalysators
Noch sind wir nicht ganz am Ende angekommen. Das abgespaltene Proton "zieht" nun das vierte Br-Atom aus dem FeBr4- - Komplex heraus, dabei entstehen HBr und FeBr3. Das ganz am Anfang eingesetzte FeBr3 hat sich also zurückgebildet. Formal nimmt es gar nicht an der Reaktion teil, ermöglicht aber überhaupt erst die Reaktion. Also kann man FeBr3 zu Recht als Katalysator bezeichnen.
Man muss aber kein FeBr3 zu den Edukten dazugeben, es reicht aus, wenn man Eisenpulver dazugibt. Das katalytisch aktive FeBr3 bildet sich dann "von selbst", wenn das Eisen mit dem gelösten Brom reagiert.