Reaktionsmechanismus der Eliminierung
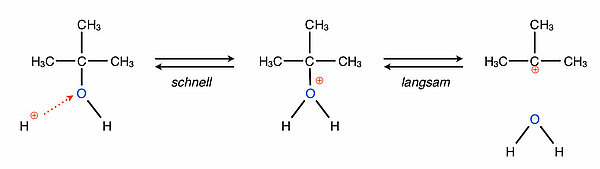
Versetzt man einen Alkohol mit einer Säure, so wird die OH-Gruppe zunächst protoniert, anschließend wird die protonierte OH-Gruppe in Form eines Wasser-Moleküls abgespalten. Es bleibt ein Carbenium-Ion zurück. Das alles kennen wir bereits vom Schritt 1 des SN1-Mechanismus der Nucleophilen Substitution.
Dieses Carbenium-Ion ist recht instabil und "versucht", seine positive Ladung irgendwie zu verlieren. Dazu gibt es zwei verschiedene Möglichkeiten.
- Anlagerung eines negativ geladenen Ions, zum Beispiel eines Bromid-Ions. Wird dieser Reaktionsweg eingeschlagen, so handelt es sich bei der Reaktion um eine Nucleophile Substitution.
- Abgabe eines Protons. Dies ist dann der Reaktionsweg der Eliminierung, bei der eine C=C-Doppelbindung entsteht, in diesem Falle bildet sich das Alken 2-Methyl-propen.
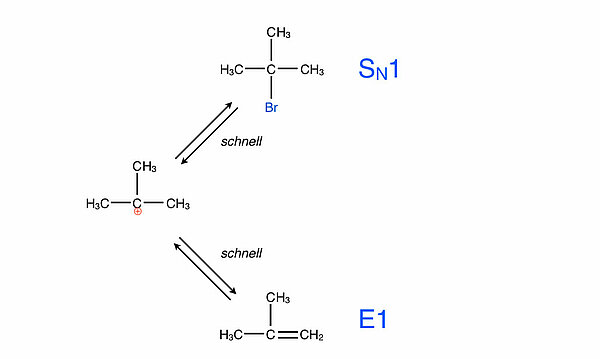
Welcher der beiden Reaktionswege eingeschlagen wird, hängt natürlich von den genauen Reaktionsbedingungen ab. Sind beispielsweise keine Anionen im Reaktionsmedium vorhanden, so kann eigentlich nur der Weg der Eliminierung eingeschlagen werden. Eine weitere Konkurrenzreaktion werden wir noch weiter unten kennenlernen, die Ether-Bildung.
Reaktionsgeschwindigkeit
Das Zwischenprodukt der Alkohol-Dehydratisierung hat entscheidenden Einfluss auf die Reaktionsgeschwindigkeit. Bekanntlich sind tertiäre Carbenium-Ionen besonders stabil, während primäre Carbenium-Ionen sehr instabil sind. Aus diesem Grund können tertiäre Alkohole besonders leicht dehydratisiert werden. In dem Chemie-Buch "Chemie heute SII" aus dem Schroedel-Verlag habe ich folgende Daten dazu gefunden: Die säurekatalysierte Dehydratisierung eines primären Alkohols erfordert Temperaturen von 200 ºC, die Dehydratisierung eines sekundären Alkohols 140 ºC, und die Dehydratisierung eines tertiären Alkohols gelingt bereits bei 80 ºC.
Etherbildung
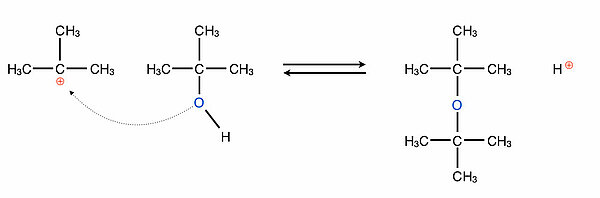
Eben hatten wir gesehen, dass die SN1-Reaktion eine Konkurrenzreaktion zur E1-Eliminierung ist und umgekehrt. Aber auch dann, wenn kein Nucleophil in dem Reaktionsmedium anwensend ist, kann eine SN1-Reaktion stattfinden. Der Alkohol kann nämlich mit sich selbst reagieren. Bei niedrigeren Temperaturen reagiert das Carbenium-Ion mit einem weiteren Alkohol-Molekül als Nucleophil und es entsteht ein Ether-Molekül:
E1-Eliminierung
Diese Art der Eliminierung, bei der im ersten Schritt ein Nucleofug als Anion oder Molekül abgespalten wird, so dass ein Carbenium-Ion als Zwischenprodukt übrig bleibt, ist übrigens nicht der einzige Eliminierungstyp, den es gibt. Man bezeichnet diesen speziellen Mechanismus, der in Konkurrenz zur SN1-Substitution ablaufen kann, auch als E1-Eliminierung. E1 deswegen, weil die Kinetik dieser Reaktion monomolekular ist. Die Abspaltung des Nucleofugs ist der langsamere Reaktionsschritt und daher auch der geschwindigkeitsbestimmende. Und da die Geschwindigkeit des ersten Schrittes nur von der Konzentration der organischen Verbindung abhängt, ist der erste Schritt monomolekular, womit auch die gesamte Reaktion monomolekular ist. Neben der E1-Eliminierung gibt es aber auch noch die E2-Eliminierung, die auf der nächsten Seite näher besprochen werden soll.
Abitur NRW
Im Zentralabitur NRW wird in einigen Aufgaben auf die Eliminierung als Konkurrenzreaktion zur SN1-Substitution eingegangen. Als Beispiel sei die Aufgabe von 2007 "Antiklopfmittel MTBE" genannt.
Insgesamt kommt das Stichwort "Eliminierung" in einer ganzen Reihe von Abituraufgaben vor, wie der folgende Screenshot einer Spotlight-Suche im Ordner "Abitur Chemie" zeigt:

Eine Suche nach "E1" oder E2" führte allerdings zu 0 Ergebnissen. Für das Chemie-Abitur in NRW reicht es offensichtlich, wenn man überhaupt weiß, dass es so etwas wie eine Eliminierung gibt. Nach welchem Mechanismus diese abläuft, scheint völlig egal zu sein.