Ein einfacher Versuch
Wenn die Schüler (m/w/d) den Eisennagel-Versuch durchgeführt haben und wir die Begriffe "Reduktion", "Oxidation", "Elektronen-Donator", "Elektronen-Akzeptor", "Redoxreaktion" und "Donator-Akzeptor-Prinzip" geklärt haben, führe ich immer den Komplementär-Versuch durch, um die Mitmenschen zum Denken anzuregen.
Versuch 2
Durchführung:
- Füllen Sie ein kleines Becherglas mitEisensulfatlösung und stellen Sie dann einen sauberen Kupfernagel in die Lösung.
- Beobachten Sie den Kupfer über einen Zeitraum von ca. 5 Minuten.
Beobachtungen:
Es passiert überhaupt nichts.
Deutung
Auf den ersten Blick gibt es an diesem Versuch nichts zu deuten, da ja nichts passiert ist. Allerdings muss jetzt die folgende Frage im Unterricht besprochen werden: Wieso passiert den nichts? Wieso geben die Kupfer-Atome keine Elektronen an die Eisen-Ionen ab?
Elektronegativität als Ursache?Im Unterrichtsgespräch kam neulich ein schlauer Schüler auf die Idee, das könne an der unterschiedlichen Elektronegativität der beiden Metalle liegen. Unter Elektronegativität versteht man ja die Fähigkeit eines Atoms, Bindungselektronen anzuziehen. Und wenn Kupfer eine höhere Elektronegativität hätte als Eisen, so würde das erklären, dass Elektronen zwar vom Eisen auf das Kupfer übertreten, aber nicht vom Kupfer auf das Eisen.
An sich ist das eine sehr intelligente Idee. Schauen wir uns doch einmal die EN-Werte von Kupfer und Eisen an.
- Kupfer: 1,9
- Eisen: 1,83
Tatsächlich hat Kupfer eine leicht höhere Elektronegativität als Eisen. Der Schüler könnte also sogar Recht haben.
Allerdings bezieht sich die Elektronegativität nicht auf irgendwelche Elektronen, sondern immer auf die Elektronen einer kovalenten Bindung, wie das folgende Zitat aus dem Lexikon der Chemie des Spektrum-Verlags zeigt:
"Elektronegativität, ein relatives Maß für das Bestreben eines Atoms in einem Molekül, Bindungselektronenpaare anzuziehen. Die E. ist ein wichtiges Kriterium für die Abschätzung der Polarität einer Bindung, das von L. Pauling (1932) entwickelt wurde."

Deutung
Auf den ersten Blick gibt es an diesem Versuch nichts zu deuten, da ja nichts passiert ist. Allerdings muss jetzt die folgende Frage im Unterricht besprochen werden: Wieso passiert den nichts? Wieso geben die Kupfer-Atome keine Elektronen an die Eisen-Ionen ab?
Elektronegativität als Ursache?Im Unterrichtsgespräch kam neulich ein schlauer Schüler auf die Idee, das könne an der unterschiedlichen Elektronegativität der beiden Metalle liegen. Unter Elektronegativität versteht man ja die Fähigkeit eines Atoms, Bindungselektronen anzuziehen. Und wenn Kupfer eine höhere Elektronegativität hätte als Eisen, so würde das erklären, dass Elektronen zwar vom Eisen auf das Kupfer übertreten, aber nicht vom Kupfer auf das Eisen.
An sich ist das eine sehr intelligente Idee. Schauen wir uns doch einmal die EN-Werte von Kupfer und Eisen an.
- Kupfer: 1,9
- Eisen: 1,83
Tatsächlich hat Kupfer eine leicht höhere Elektronegativität als Eisen. Der Schüler könnte also sogar Recht haben.
Allerdings bezieht sich die Elektronegativität nicht auf irgendwelche Elektronen, sondern immer auf die Elektronen einer kovalenten Bindung, wie das folgende Zitat aus dem Lexikon der Chemie des Spektrum-Verlags zeigt:
"Elektronegativität, ein relatives Maß für das Bestreben eines Atoms in einem Molekül, Bindungselektronenpaare anzuziehen. Die E. ist ein wichtiges Kriterium für die Abschätzung der Polarität einer Bindung, das von L. Pauling (1932) entwickelt wurde."
Das Redoxpotenzial
Die Idee mit der Elektronegativität ist schon gar nicht mal so verkehrt. Atome, die bei einer polaren Bindung einen großen Drang haben, Elektronen an sich zu ziehen, haben vielleicht auch bei Redoxreaktionen eine große Tendenz, Elektronen aufzunehmen. Aber für Redoxreaktionen gibt es eine wesentlich bessere Messgröße, nämlich das sogenannte Redoxpotenzial.
Wörtlich übersetzt bedeutet "Redoxpotenzial" so viel wie "Fähigkeit zum Reduzieren". Eisen-Atome haben die Fähigkeit, Kupfer-Ionen zu reduzieren, das hat unser Eisennagel-Versuch gezeigt. Umgekehrt haben Kupfer-Atome nicht die Fähigkeit, Eisen-Ionen zu reduzieren, wie unser Kupfernagel-Versuch gezeigt hat.
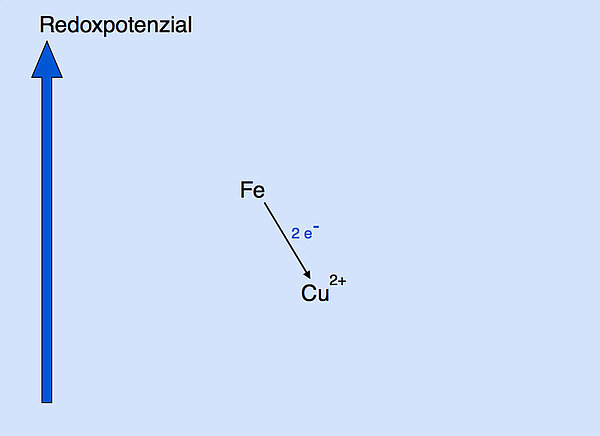
Bei einer Redoxreaktion "fließen" die Elektronen vom Elektronendonator zum Elektronenakzeptor, ähnlich wie Wasser von oben nach unten fließt. Das kann man sich mit folgender Zeichnung veranschaulichen:

Vom Eisen (Eisen-Atomen) zum Kupfer (Kupfer-Ionen) fließen die Elektronen sozusagen bergab. Das geschieht freiwillig und ohne Zufuhr von Energie. Im Gegenteil, man könnte Energie aus diesem Vorgang gewinnen, bei Batterien und Akkumulatoren wird das sogar gemacht.
Vom Kupfer zum Eisen müssten die Elektronen bergauf fließen. Das ginge nur unter Einsatz von Energie. Wenn man Wasser bergauf transportieren will, muss man ja auch Pumpen einsetzen, die Energie benötigen.
Weitere Versuche
Versuch 3
Durchführung:
Fünf kleine Becherglas werden mit Salzlösungen der Metalle Eisen, Kupfer, Magnesium, Silber und Zink gefüllt. In diese Salzlösungen werden dann Bleche der entsprechenden Metalle eingetaucht.
Beobachtungen:
Bei manchen Kombinationen wie zum Beispiel Eisenblech in Kupfesulfat-Lösung kann man eine Reaktion beobachten, es bildet sich auf dem Blech ein deutlicher Belag. Bei anderen Kombinationen, beispielsweise Kupferblech in Zinksulfat-Lösung, kann man keine Reaktion bilden; das Aussehen des Blechs ändert sich nicht. Am besten, man notiert die Ergebnisse in einer Tabelle.
| Fe | Cu | Mg | Ag | Zn | |
|---|---|---|---|---|---|
| FeSO4 | o | o | ++ | o | + |
| CuSO4 | ++ | o | ++ | o | ++ |
| MgCl2 | o | o | o | o | o |
| AgNO3 | ++ | ++ | ++ | o | ++ |
| ZnSO4 | o | o | + | o | o |
Mit (++), (+) oder (o) - Symbolen kann man die Intensität der jeweiligen Reaktion halb-quantitativ notieren.
Auswertung
Auffällig ist, dass Mg-Atome in allen Fällen Elektronen abgeben. Augenscheinlich ist Mg hier das unedelste Metall, denn es gibt "sehr gern" Elektronen an Elektronen-Akzeptoren ab. Mg hat das stärkste Redoxpotenzial.
Eisen-Atome geben in zwei Fällen Elektronen an einen Akzeptor ab, nämlich an Kupfer-Ionen und an Silber-Ionen. Eisen ist also auch ziemlich unedel, allerdings nicht ganz so unedel wie Zink oder gar Magnesium. Zink-Atome geben Elektronen an Eisen-Ionen ab, sind also noch unedler als Eisen. Zink hat also das zweitstärkste Redoxpotenzial von den vier untersuchten Metallen, und Eisen hat das drittstärkste Redoxpotenzial.
Kupfer-Atome sind schon recht edel, sie geben ihre Elektronen nur an Silber ab, genauer gesagt, an Silber-Ionen.
Silber ist hier das edelste Metall, es zeigt keinerlei Bereitschaft, Elektronen an andere Metall-Ionen abzugeben und hat damit das schwächste Redoxpotenzial von allen fünf Metallen.
Stellen wir die Ergebnisse des dritten Versuchs graphisch dar:

Die obige Zeichnung enthält noch zwei sachliche Fehler bzw. Mängel.
Fehler Nr. 1Magnesium-Atome geben keine Elektronen an Zink-Atome ab, wohl aber an Zink-Ionen. Genauso verhält es sich mit den anderen Atomen. Wie könnte man dies in der Graphik berücksichtigen?
Erinnern Sie sich an die Säure/Base-Paare aus der Säure/Base-Chemie? Wenn die Säure HCl ein Proton abgibt, entsteht die korrespondierende Base Cl-, man schreibt dieses Säure/Base-Paar daher als HCl/Cl-.
Analog kann man bei Redoxreaktionen verfahren. Wenn ein Zn-Atom zwei Elektronen abgibt, entsteht ein Zn2+-Ion. Dieses Ion ist in der Lage, Elektronen von einem anderen Elektronen-Donator aufzunehmen, beispielsweise von einem noch unedleren Metall wie Magnesium. Statt der Atome wie Mg, Zn etc. könnte man also die Redoxpaare Mg/Mg2+, Zn/Zn2+ etc. hinschreiben:

Fehler Nr. 2
Die vertikalen Abstände zwischen den Redoxpaaren sind noch nicht korrekt. Woher weiß man denn, dass der Fe-Cu-Abstand größer ist als etwa der Cu-Ag-Abstand? Könnte es nicht auch umgekehrt sein? Und überhaupt, welche Werte haben die Redoxpotenziale eigentlich? In welcher physikalischer Einheit werden Redoxpotenziale gemessen, und wie muss man die senkrechte Achse der Graphiken einteilen und beschriften.
Mit diesen Fragen beschäftigen wir uns im nächsten Abschnitt der Elektrochemie.
Für Experten
Wer noch mehr Einzelheiten zum Thema Redoxpotenzial wissen möchte, schaut sich die entsprechende Seite in meinem Chemie-Lexikon an.