Ein Begriff aus der Elektrochemie. Eine Redoxreaktion ist chemische Donator-Akzeptor-Reaktion, bei der eine Oxidation und eine Reduktion zeitgleich ablaufen. Der Begriff der Redoxreaktion wird im Chemieunterricht in drei verschiedenen Stufen eingeführt:
Übertragung von Sauerstoff
Redoxreaktion = Übertragung von Sauerstoff
Ein bekanntes Beispiel aus dem Chemie-Unterricht der 7. oder 8. Klasse ist die Reaktion von Kupferoxid mit elementarem Wasserstoff, bei der Wasser und metallisches Kupfer entstehen. Das Kupferoxid gibt den Sauerstoff ab, wird also reduziert, und der Wasserstoff nimmt den Sauerstoff auf, wird also oxidiert. Insgesamt findet eine Übertragung von Sauerstoff statt.
Übertragung von Wasserstoff
Redoxreaktion = Übertragung von Wasserstoff
Dieser Begriff wird gern in der organischen Chemie sowie in der Biochemie verwendet. Ein bekanntes Beispiel ist die Oxidation eines primären Alkohols mit Kupferoxid. Ein heißes oxidiertes Kupferblech wird in den flüssigen Alkohol gehalten, dabei wird der Alkohol zum Aldehyd oxidiert und aus dem Kupferoxid entsteht wieder reines Kupfer.
Betrachten wir nun die Oxidation eines Alkohols genauer:
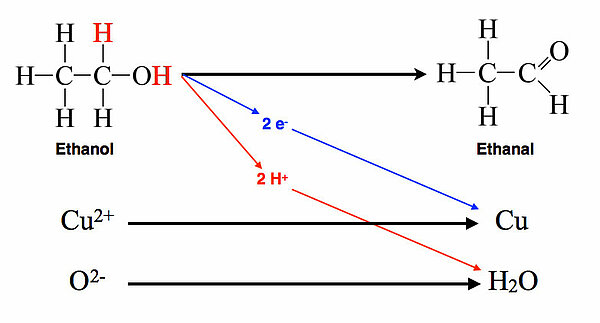
Rein formal werden zwei Wasserstoff-Atome vom Ethanol auf das Kupferoxid übertragen. Bei näherer Betrachtung stimmt das allerdings nicht ganz. Jedes H-Atom wird in Form eines Elektrons und eines Protons übertragen. In der Biochemie spricht man hier auch von Reduktionsäquivalenten. Die beiden Protonen des Ethanols verbinden sich mit dem Sauerstoff-Anion des Kupferoxids, und die beiden Elektronen reduzieren die Kupfer(II)-Ionen zu metallischem Kupfer.
Bei der Bildung von Natriumchlorid (NaCl) aus den Elementen Natrium und Chlor nimmt das Chlor Elektronen auf, es wird also reduziert. Diese Elektronen werden vom Natrium "gespendet", das dabei oxidiert wird (siehe Oxidation).
