Bei der Isomerie unterscheidet man grundsätzlich zwischen Konstitutionsisomerie und Konformationsisomerie. Der "simpelste" Fall ist die Konformationsisomerie. Durch einfaches Drehen um eine Einfachbindung kann man zwei Konformationsisomere ineinander überführen. Bei der Konstitutionsisomerie haben die Isomere verschiedene Strukturen, die sich in unterschiedlichen Strukturformeln zeigen. Nur durch Trennen von kovalenten Bindungen kann man zwei Konstitutionsisomere ineinander überführen. Stereoisomere haben zwar die gleiche Konstitution, unterscheiden sich aber trotzdem in der räumlichen Anordnung der Atome. Das bekannteste Beispiel für Stereoisomerie ist die Enantiomerie, bei der sich die beiden Isomere wie Bild und Spiegelbild verhalten (siehe Abbildung 1). Aber auch andere Formen der Stereoisomerie sind möglich, man denke nur an die cis-trans-Isomerie der Cycloalkane (Abbildung 3) und Alkene (Abbildung 4).
Diastereomere sind nun Stereoisomere, die keine Enantiomere sind, sich also nicht wie Bild und Spiegelbild verhalten. Für eine solche Diastereomerie gibt es mehrere verschiedene Ursachen.
1. Diastereomerie aufgrund mehrerer ChiralitätszentrenEin organisches Molekül hat Spiegelbild-Isomere, wenn es über ein sogenanntes Chiralitätszentrum verfügt. Ein solches Chiralitätszentrum ist ein C-Atom, das vier verschiedene Substituenten hat.

Beim 1-Chlor-ethanol ist das C-Atom mit der OH-Gruppe und dem Cl-Atom ein solches Chiralitätszentrum. Dieses C-Atom ist mit vier verschiedenen Substitutenten verbunden:
- Chlor-Atom
- OH-Gruppe
- H-Atom
- Methyl-Gruppe
Was ist aber, wenn ein Molekül zwei solcher Chiralitätszentren hat? Zeichnen wir uns ein solches Molekül einmal auf.
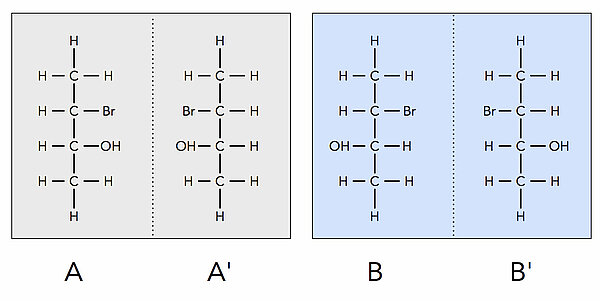
Wir haben hier zwei Chiralitätszentren, nämlich am C-Atom 2 und am C-Atom 3. Die Strukturen A und A' verhalten sich wie Bild und Spiegelbild, sind also Enantiomere. Das Gleiche gilt für die Strukturen B und B'.
Aber in welchem Verhältnis stehen A und B oder A und B' zueinander? Das Römpp Chemie-Lexikon definiert Diastereomerie folgendermaßen:
"Diastereo(iso)merie (von griech. dia = jenseits). Nach IUPAC-Regel E-4.6 werden Stereoisomere, die nicht enantiomer zueinander sind, als Diastereomere bezeichnet."[1]Die "Übersetzung" könnte ungefähr so lauten wie in dem Wikipedia-Artikel "Diastereomer":
"Diastereomere sind Stereoisomere, welche sich - im Gegensatz zu Enantiomeren - nicht wie Bild und Spiegelbild verhalten."[2]Auf unser Beispiel bezogen, heißt das also, dass A und A' keine Diastereomere sind, sondern Enantiomere. A und B sowie A und B' sind dagegen echte Diastereomere.
Schauen wir uns nun die etwas kompliziertere Definition aus der Wikipedia an:
"Zwischen zwei molekularen Verbindungen mit gleicher Konstitution und mehreren Stereozentren liegt Diastereomerie vor, wenn sie sich in mindestens einem, jedoch nicht in allen Stereozentren unterscheiden". [2]Auch diese Aussage wird verständlich, wenn wir sie auf unser letztes Beispiel beziehen. A und A' unterscheiden sich an beiden Chiralitätszentren. Bei A ist Brom rechts, bei A' dagegen links gezeichnet. Bei A ist die OH-Gruppe rechts, und bei A' links gezeichnet. Daher verhalten sich A und A' wie Bild und Spiegelbild.
Betrachten wir nun A und B. In Bezug auf das erste Chiralitätszentrum unterscheiden sich die beiden Strukturen nicht, in beiden Strukturen befindet sich das Brom-Atom auf der rechten Seite. A und B unterscheiden sich nur in einem Chiralitätszentrum. Damit wird die Bedingung "in mindestens einem, jedoch nicht allen Sterozentren" erfüllt.
2. Diastereomerie bei zyklischen VerbindungenDas "Musterbeispiel" hierfür ist in meinem Chemie-Unterricht immer das Cyclohexen. Addiert man beispielsweise Chlor an dieses Alken, so erhält man zwei verschiedene 1,2-Dichlorcyclohexane, nämlich das cis-1,2-Dichlor-cyclohexan und das trans-1,2-Dichlor-cyclohexan. Beim cis-Isomer liegen dann beide Cl-Atome auf der gleichen Seite der Ringebene, beim trans-Isomer befindet sich das eine Cl-Atom oberhalb, das andere unterhalb der Ringebene:
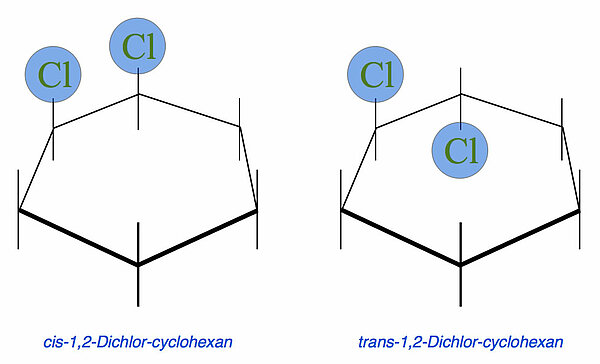
Man beachte, dass beide Isomere die gleiche Konstitution haben: Sechs C-Atome sind ringförmig miteinander verbunden und durch H-Atome abgesättigt. An zwei benachbarten C-Atomen befinden sich zwei Chlor-Atome. Die räumliche Anordnung der Atome innerhalb dieser Konstitution ist aber unterschiedlichen, daher handelt es sich um Stereoisomere. Allerdings nicht um Enantiomere, da die beiden Isomere sich nicht wie Bild und Spiegelbild verhalten. Alle Stereoisomere, die sich nicht wie Bild und Spiegelbild verhalten, sind Diastereomere. In diesem Fall cis-trans-Isomere.
3. Diastereomerie bei ungesättigten VerbindungenAuch bei Alkenen und anderen Verbindungen mit einer C=C-Doppelbindung tritt die cis-trans-Isomerie als besondere Form der Diastereomerie auf.
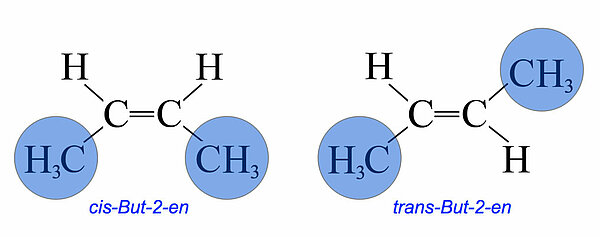
In Abbildung 4 sehen wir das einfache Beispiel mit dem But-2-en bzw. 2-Buten.
Zum Schluss noch eine Bemerkung zu den physikalischen Eigenschaften der verschiedenen Isomere. Während Enantiomere (Bild / Spiegelbild) in allen physikalischen Eigenschaften übereinstimmen (ausgenommen die Art und Weise, wie polarisiertes Licht von solchen Verbindungen gedreht wird), unterscheiden sich cis-trans- und andere Diastereomere in ihren physikalischen Eigenschaften. Die beiden 2-Butene in Abbildung 4 haben beispielsweise unterschiedliche Siedepunkte. Das cis-Isomer ist ein stärkerer Dipol als das trans-Isomer, weil beim cis-Isomer die +I-Effekte der beiden Methylgruppen in die gleiche Richtung wirken, beim trans-Isomer dagegen in entgegengesetzte Richtungen.
Auch chemisch können sich Diastereomere voneinandner unterscheiden. Sterische Effekte spielen eine große Rolle bei der Aktivierungsenergie chemischer Reaktionen. Diese Aktivierungsenergien können sich bei verschiedenen Diastereomeren voneinander unterscheiden, und so können chemische Reaktionen auch mal langsamer, mal schneller ablaufen, jenachdem, welches der Diastereomere vorliegt.
Selbst Enantiomere können sich in ihrem chemischen Verhalten unterscheiden, obwohl das auf den ersten Blick eher unwahrscheinlich ist. Aber wenn es sich beispielsweise um enzymatisch katalysierte Reaktionen handelt, die nach dem Schlüssel-Schloss-Prinzip arbeiten, macht es schon einen Unterschied, ob das cis-Isomer versucht, in das aktive Zentrum zu gelangen, oder das trans-Isomer. Das ist dann in etwa so, als würde man versuchen, mit der linken Hand in einen rechten Handschuh zu gelangen. Es geht, es ist aber schwer.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia, Artikel "Diastereomer", aufgerufen am 5. April 2020.