Versuch zur Denaturierung von Proteinen
Material:
2 Tassen, 7 Reagenzgläser, Reagenzglasständer, Messzylinder 100 ml, 5 Tropfpipetten, Wasserbad.
Ein Hühnerei, Salzsäure (25%), Kupfersulfatlösung (5%), Ethanol, Natronlauge (25%), Ammoniumsulfatlösung (gesättigt), dest. Wasser.
Durchführung:
Stellen Sie zunächst eine Eiweißlösung her:
- Ei aufschlagen,
- In einer Tasse Eigelb vom Eiklar trennen,
- Eiklar in der anderen Tasse mit 100 ml dest. Wasser versetzen und gut vermischen,
- die Eiklarlösung auf sieben Reagenzgläser aufteilen, jeweils ca zu 1/4 bis 1/3 füllen.
Führen Sie dann folgende Teilversuche mit den sieben Reagenzgläsern durch:
- in ein heißes Wasserbad stellen,
- mit etwas Salzsäure versetzen,
- mit etwas Kupfersulfatlösung versetzen,
- mit etwas Natronlauge versetzen,
- mit etwas Ethanol versetzen,
- mit etwas Leitungswasser versetzen (Kontrollversuch).
Beobachten Sie genau, in welchem Reagenzglas eine Denaturierung stattfindet und in welchem nicht. Dokumentieren Sie die Versuchsergebnisse.
Denaturierung
Bei der Denaturierung eines Proteins verändert sich dessen Tertiärstruktur, teilweise sind auch die Sekundärstrukturen davon betroffen. Die Primärstruktur bleibt aber meistens erhalten, die Reihenfolge der Aminosäuren wird durch eine Denaturierung in der Regel also nicht verändert.
Wenn sich die Tertiärstruktur des Proteins verändert, geht automatisch auch seine Funktion verloren. Ein Enzym beispielsweise verliert seine enzymatische Aktivität.
Denaturierung durch Hitze
Bei der Hitzedenaturierung werden schwache chemische Bindungen wie H-Brücken, hydrophobe Wechselwirkungen, van-der-Waals-Kräfte oder Dipol-Wechselwirkungen aufgebrochen. Das liegt daran, dass durch die Zufuhr thermischer Energie die Protein-Moleküle in Schwingungen geraten. Je höher die Temperatur, desto stärker die Schwingungen, bis schließlich zunächst schwache Bindungen, bei höherer Temperatur aber auch starke chemische Bindungen aufgebrochen werden. Solche Hitzedenaturierungen können unter Umständen reversibel sein.
Fieber
Lebewesen werden durch Hitze geschädigt. Bei Temperaturen über 40 ºC beginnen auch die Proteine des menschlichen Körpers zu denaturieren, manche Proteine etwas eher, manche etwas später. Das gilt auch für die Proteine von eingedrungenen Krankheitserregern. Darum erhöht der Körper seine Temperatur (Fieber), wenn man sich infiziert hat. Ziel des Fiebers ist es, die Krankheitserreger durch Denaturierung ihrer Proteine abzutöten.
Disulfid-Brücken
Auch Disulfid-Brücken (S-S) können durch Hitzedenaturierung aufgebrochen werden. Meistens ist diese Art der Denaturierung irreversibel. Ein einmal gekochtes Hühnerei kann nicht mehr in den ursprünglichen flüssigen Zustand zurückversetzt werden.
Sterilisieren
Anwendungen findet die Hitzedenaturierung zum Beispiel beim Autoklavieren, also beim Sterilmachen medizinischer Geräte durch Hitze (> 100 ºC) und erhöhtem Druck.
Enzyme haben ein Temperaturoptimum

In der Abbildung sehen wir, wie die Aktivität eines Enzyms von der Temperatur abhängt. Es handelt sich hier um eine typische Optimumskurve, bei einer Temperatur von 30 Grad Celsius arbeitet unser fiktives Beispielenzym am besten. Bei kälteren Temperaturen setzt das Enzym seine Substrate nicht mehr so schnell um. Das liegt eindeutig an der RGT-Regel (Reaktionsgeschwindigkeits-Temperatur-Regel): Eine Erhöhung der Temperatur um 10 ºC verdoppelt die Geschwindigkeit biochemischer Reaktionen.
Eigentlich müsste das Enzym bei 40 ºC doppelt so schnell arbeiten wie bei 30 ºC. Das ist aber nicht der Fall, im Gegenteil, die Enzymaktivität sinkt rapide. Das liegt an der zunehmenden Denaturierung des Enzyms. Die Tertiärstruktur verändert sich, und das wirkt sich auch auf das aktive Zentrum des Enzyms aus, das ja für die Verarbeitung des Substrats verantwortlich ist. Das Schlüssel-Schloss-Prinzip funktioniert nicht mehr. Wenn das Schloss verformt ist, passt der Schlüssel nicht mehr hinein.

Auf diesem Bild ist sehr schön dargestellt, wie sich ein globuläres Protein unter Hitzeeinwirkung entfaltet.
Denaturierung durch Säuren und Laugen
Säuren
Säuren geben Protonen ab, die sich dann an negativ geladene Carboxy-Gruppen in den Seitenketten der sauren Aminosäuren setzen können. Diese Seitenketten verlieren dann ihre negativen Ladungen, und der Zusammenhalt der Tertiärstruktur an diesen Stellen geht dann verloren, weil die positiv geladenen "gegenüberliegenden" Aminosäuren keinen Bindungspartner mehr haben.
Laugen
Laugen enthalten Hydroxid-Ionen, welche Protonen aus dem Protein aufnehmen. Dadurch verlieren die positiv geladenen Seitenketten basischer Aminosäuren ihre positive Ladung, mit dem gleichen Effekt wie bereits eben beschrieben.
Außerdem kann ein Überschuss und vor allem ein Mangel an Protonen sich auf H-Brücken auswirken, die ja die Sekundärstrukturen des Proteins stabilisieren.
Hydrolyse schädigt die Primärstruktur
Schließlich kann durch einen starken Überschuss an Säure oder Lauge sogar eine Hydrolyse des Proteins stattfinden, dass heißt, eine Spaltung von Peptidbindungen. Diese Art der Denaturierung wirkt sich dann sogar auf die Primärstruktur aus.
Enzyme haben ein pH-Optimum
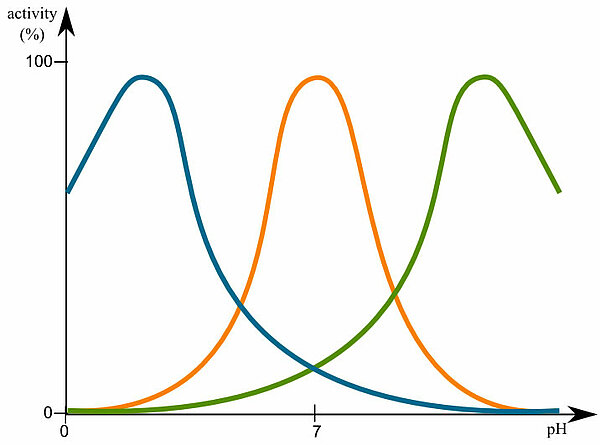
Auf diesem Bild sieht man drei verschiedene Enzyme und wie ihre Aktivität vom pH-Wert abhängig ist. Das blau gezeichnet Enzym hat beispielsweise eine optimale Aktivität bei einem pH-Wert von 2 - 3, das orange gezeichnet Enzym hat sein pH-Optimum bei pH 6 - 8, und das grün gezeichnet Enzym hat sein pH-Optimum im stark alkalischen Bereich, schätzungsweise pH 10 - 11.
Die Enzyme unseres Verdauungssystems unterscheiden sich ebenfalls in ihrer pH-Abhängigkeit. Das Pepsin des Magens muss zum Beispiel bei stark sauren pH-Werten (teils < 2) optimal arbeiten. Im Dünndarm dagegen herrscht ein leicht alkalisches Milieu. Das Trypsin, das Chymotrypsin etc. muss also bei pH-Werten um 8 gut arbeiten. Pepsin, das mit dem Nahrungsbrei in den Dünndarm gelangt, wird dort sofort inaktiv.
Denaturierung durch Salze
Salze bestehen aus positiv und negativ geladenen Ionen. Diese können mit den negativ bzw. positiv geladenen Seitenketten des Proteins wechselwirken, so dass die Ionenbindungen zerstört werden, welche die Tertiärstruktur zusammenhalten.
Denaturierung durch Schwermetalle
Schwermetalle wie Kupfer (Blei, Cadmium etc.) reagieren mit den Schwefelresten in den Seitenketten von Cystein zu schwerlöslichen Cu-S-Verbindungen. Außerdem können die positiv geladenen Metall-Ionen ebenfalls mit den negativ geladenen Carboxylgruppen in den Seitenketten der sauren Aminosäuren Komplexe bilden. Gerade Kupfer-Ionen bilden sehr feste Bindungen zum Protein aus, so dass diese Art der Denaturierung irreversibel ist.
Denaturierung durch Tenside
Auch Tenside aus Waschmitteln oder Spülmitteln können Proteine denaturieren, wie das folgende Bild schön zeigt:
Denaturierung durch Ethanol und andere organische Lösemittel
Ethanol und andere Alkohole wirken sich vor allem auf H-Brücken und hydrophobe Wechselwirkungen aus, welche die Sekundär- und Tertiärstruktur stabilisieren. Diese Art der Denaturierung wird beim Desinfizieren angewandt.
Denaturierung durch destilliertes Wasser
Natürlich vorkommende Proteine liegen nie isoliert vor, sondern sind mit Salzen und organischen Molekülen assoziiert, die teilweise auch für den Erhalt der Tertiärstruktur verantwortlich sind. Entfernt man diese Komponenten durch Dialyse, kann die Raumstruktur oft nicht mehr aufrecht erhalten werden, es kommt ebenfalls zu einer Denaturierung.
Denaturierung durch Luftsauerstoff
Sauerstoff kann auf Cystein-Reste einwirken und aus den SH-Gruppen Sulfongruppen machen -SO3H.
Erklärung des Ausflockens
Gibt man genug Essig in einen Topf mit Milch, so flockt diese aus. Offensichtlich führt die Zugabe der Säure zu einer Erniedrigung der Wasserlöslichkeit des Milchproteins. Das kann man folgendermaßen erklären:
Im Innern des gefalteten Proteins befinden sich viele hydrophobe Aminosäuren. Das hat energetische Gründe, in einem polaren Lösemittel wie Wasser ist es energetisch ungünstig, wenn sich die hydrophoben Aminosäuren im Außenbereich befinden.
Durch das Entfalten des Proteins gelangen diese hydrophoben Seitenketten nun in Kontakt mit Wasser und erniedrigen so die Wasserlöslichkeit des Proteins.
Aber das ist nicht der einzige und wichtigste Effekt. Der Kontakt von hydrophoben Seitenketten mit dem Wasser ist energetisch ungünstig. Die einzelnen entfalteten Proteinketten lagern sich jetzt neu zusammen, und zwar so, dass die hydrophoben Seitenketten miteinander in Kontakt kommen. So bilden sich immer größere "Klumpen" aus Proteinketten, die man dann mit bloßem Auge als "Flocken" beobachten kann.
Solche Prozesse spielen auch eine wichtige Rolle, wenn man ein Ei kocht, ein Spiegelei zubereitet oder Brot oder Kuchen backt.
Tolle Animation
Auf der Webseite "Essentials of Anatomy & Physiology" unter www.highered.mheducation.com findet sich eine tolle Flash-Animation zur Denaturierung von Proteinen. Zwar auf englisch, aber mit gut lesbaren Untertiteln. Sehr empfehlenswert!