Addition von HBr an Ethen
Zu diesem Thema gibt es jetzt eine Präsentation "Hydrobromierung", die Sie gegen eine kleine Kostenbeteiligung von mir für Ihren Unterricht erhalten können".
Im Chemieunterricht sollte als erstes Beispiel der elektrophilen Addition die Hydrobromierung behandelt werden, weil dieser Mechanismus recht einfach verläuft. Es gibt keinen pi-Komplex, keinen sigma-Komplex und auch kein Bromonium-Ion wie bei der Bromierung von Ethen. Allerdings bilden sich Carbenium-Ionen als Zwischenprodukt, und das ist für manche Schüler(innen) nicht so ganz einfach zu verstehen. Kenntnisse des Orbitalmodells sind dann äußerst hilfreich.
Bromwasserstoff ist eine Brönsted-Säure und gibt als solche leicht Protonen ab, falls das Lösungsmittel eine solche heterolytische Dissoziation unterstützt. Dann ist die Addition eines Protons an die C=C-Doppelbindung überhaupt kein Problem.
In einem unpolaren Lösungsmittel wird die Dissoziation des HBr-Moleküls jedoch nicht unterstützt, und wenn die Reaktion in der Gasphase abläuft, kann von einer Heterolyse des HBr-Moleküls überhaupt nicht die Rede sein. Dennoch findet man auch hier Beispiel für Hydrobromierungen.
Hydrobromierung in der GasphaseIn der Gasphase ist das HBr-Molekül ein starker Dipol, mit der positiven Ladung am H-Atom konzentriert und der negativen Ladung am Br-Atom. Das positiv polarisierte H-Atom kann dann die Rolle eines Elektrophils spielen, ist also "auf der Suche" nach negativen Ladungen oder nach Regionen in anderen Molekülen mit hoher Elektronendichte.
Kommt nun in der Gasphase ein HBr-Dipol in die Nähe einer C=C-Doppelbindung, so wird in dem Alken ein temporärer Dipol induziert. Die Elektronen der pi-Bindung werden von dem positiven Pol des Dipols angezogen, also vom H-Atom des Bromwasserstoffs.
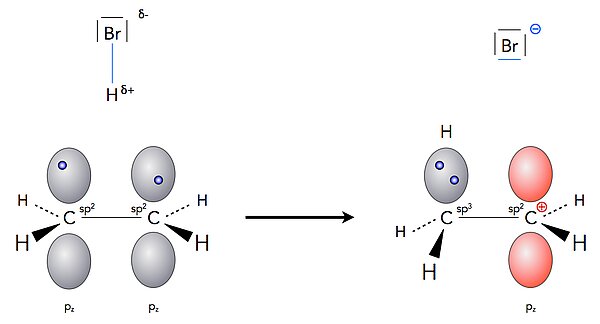
Im ersten langsamen und damit geschwindigkeitsbestimmenden Schritt der HBr-Addition bildet sich eine sigma-Bindung zwischen dem einen C-Atom und dem H-Atom des Bromwasserstoffs aus. Die beiden Elektronen der pi-Bindung "klappen" gewissermaßen um und werden zu den Bindungselektronen der neuen kovalenten C-H-Bindung.
Das andere pz-Orbital der pi-Bindung geht "leer aus", es enthält jetzt kein Elektron mehr. Das entsprechende C-Atom ist positiv geladen.
In der Gasphase gibt es keine Lösemittel, welche das Carbenium-Ion stabilisieren können, auch das Bromid-Anion kann hier nicht stabilisiert werden. Polare Lösemittel könnten jetzt Hüllen um die Ionen bilden und diese dadurch stabilisieren; Sie kennen das sicherlich vom Lösemittel Wasser, wo sich immer Hydrathüllen bilden, wenn Ionen gelöst werden.
Im zweiten Schritt, der sehr schnell abläuft und daher keinen Einfluss auf die Gesamtgeschwindigkeit der Reaktion hat, setzt sich nun ein Bromid-Ion an das Carbenium-Ion, und die Reaktion ist mit der Bildung des Endproduktes abgeschlossen.
Hydrobromierung in wässriger LösungLöst man Bromwasserstoff in Wasser oder einem anderen polaren Lösemittel, so dissoziiert das HBr-Molekül heterolytisch in Protonen und Bromid-Anionen. Die Protonen verbinden sich nun mit Wasser-Molekülen zu Oxonium-Ionen. Diese H3O+-Ionen sind nun die eigentlichen Elektrophile und setzen sich an die C=C-Doppelbindung des Alkens
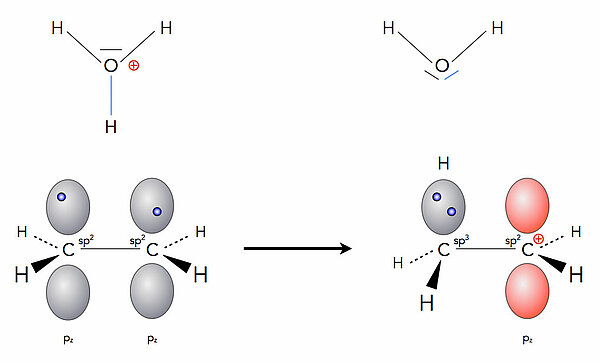
Ein Proton wird vom Oxonium-Ion abgespalten, bildet eine kovalente Bindung mit einem der beiden C-Atome der Doppelbindung aus, und das andere C-Atom wird zum Carbenium-Ion. Im Prinzip verläuft die Reaktion so wie in der Gasphase, nur ist die Reaktionsgeschwindigkeit deutlich höher, da alle Ionen jetzt durch das polare Lösemittel stabilisiert werden (Bildung von Hydrathüllen).
In einer wässrigen Lösung sind auch immer Hydroxid-Ionen anwesend. Diese sind basisch und gleichzeitig nucleophil, können sich also an das positive C-Atom des Carbenium-Ions anlagern. In diesem Fall entsteht dann aber kein Brom-Alkan, sondern ein Alkohol.