Von dieser Seite gibt es auch eine Version speziell für die Stufe EF!
Ethen ist das einfachste Alken und soll daher hier besonders berücksichtig werden. Vieles, was zum Ethen gesagt werden kann, trifft auch auf die anderen höheren Alkene zu.
Struktur
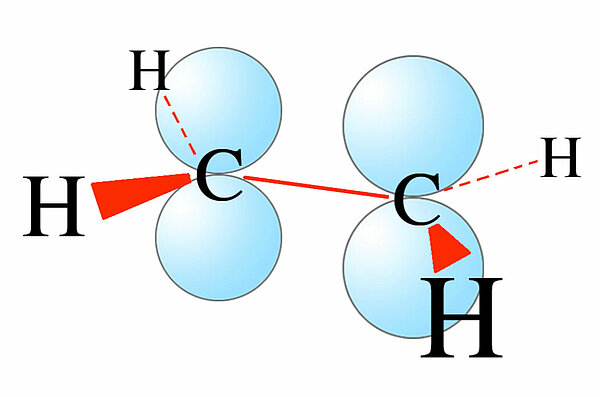
Die beiden Kohlenstoff-Atome im Ethen sind sp2-hybridisiert, daher ist das Ethen-Molekül völlig planar, alle sechs Atome liegen in einer Ebene. Durch die schwache Überlappung der beiden pz-Orbitale entsteht die schwache sigma-Bindung.
Strukturdaten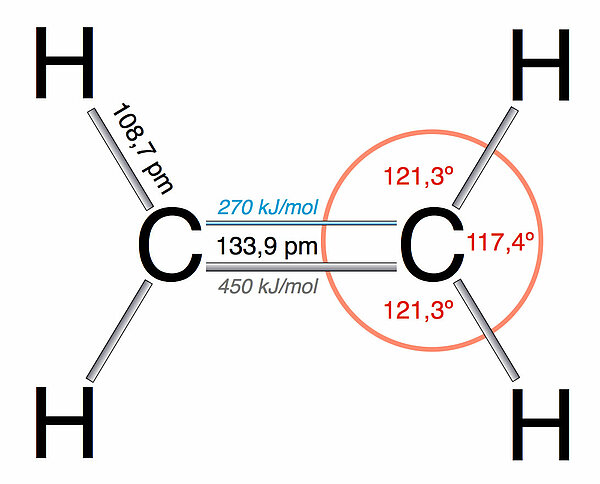
Die folgende Tabelle zeigt die Strukturdaten von Ethan und Ethen im direkten Vergleich.
| Ethan | Ethen | |
|---|---|---|
| Länge der C-C-Bindung | 154,0 pm | 133,9 pm |
| Länge der C-H-Bindungen | 109,0 pm | 108,7 pm |
| Winkel der H-C-C-Bindung | 109,5º | 109,5º |
| Winkel der H-C-H-Bindung | 121,3º | 117,4º |
| Bindungsenergie der C-C-Sigma-Bindung | 369 kJ/mol | 450 kJ/mol |
| Bindungsenergie der C-C-Pi-Bindung | --- | 270 kJ/mol |
| Räumliche Struktur des Moleküls | tetraedrisch | planar |
Die Ursache für die Unterschiede in den Bindungslängen und den Bindungswinkeln ist offensichtlich die sp2-Hybridisierung der C-Atome im Ethen-Molekül. Die sp2-Hybridorbitale sind kleiner bzw. kürzer als die sp3-Hybridorbitale des Ethans, und vor allem sind die sp2-Hybridorbitale im 120º-Winkel angeordnet und nicht im 109º-Winkel wie die sp3-Hybridorbitale des Ethans.
Physikalische Eigenschaften
Ethen ist ein farbloses, geruchloses und leicht betäubend wirkendes brennbares Gas. Der Schmelzpunkt liegt bei -169,1 ºC, der Siedepunkt bei -103,7 ºC. Die Wasserlöslichkeit kann vernachlässigt werden, in unpolaren Lösemitteln ist Ethen dagegen sehr gut löslich ("Gleiches löst Gleiches"). Ethen hat ähnliche physikalische Eigenschaften wie Ethan, das liegt hauptsächlich daran, dass auch die Ethen-Moleküle nur sehr schwache intermolekulare Anziehungskräfte besitzen.
Chemische Eigenschaften
Elektrophile Addition
Die C=C-Doppelbindung bestimmt die chemischen Eigenschaften des Ethens. Die Doppelbindung ist wegen der hohen Elektronendichte Angriffsziel von elektrophilen Stoffen. Die typische Reaktion von Ethen (und den anderen Alkenen) ist die Elektrophile Addition. Dieser wichtige Reaktionsmechanismus ist auf den entsprechenden Seiten ausführlich erläutert, daher muss hier nicht weiter darauf eingegangen werden.
Oxidation / VerbrennungAndere wichtige Reaktionen des Ethens sind natürlich seine Oxidation; unter ausreichender Sauerstoffzufuhr verbrennt Ethen sauber zu Wasser und Kohlendioxid und liefert dabei recht viel Wärmeenergie:
$H_{2}C=CH_{2} + 3 O_{2} \to 2 CO_{2} + 2 H_{2}O$ mit $\Delta H = -1411 kJ/mol$
Da hier eine C=C-Doppelbindung gespalten werden muss, ist die Energiebilanz nicht ganz so günstig wie bei der Verbrennung von Ethan ($\Delta H = -1560 kJ/mol$).
PolymerisationViele einfache Alkene sind Bausteine für wichtige Kunststoffe. Der weltweit am meisten produzierte Kunststoff, das Polyethylen, wird aus dem Ethen hergestllt. Einzelheiten dazu siehe die Seite über Polyethylen.