Von dieser Seite gibt es auch eine Version speziell für die StufeQ1/Q2!
Ethen ist das einfachste Alken und soll daher hier besonders berücksichtig werden. Vieles, was zum Ethen gesagt werden kann, trifft auch auf die anderen höheren Alkene zu.
Struktur
Typisch für Ethen und alle anderen Glieder der homologen Reihe der Alkene ist die Doppelbindung zwischen zwei Kohlenstoff-Atomen, die sogenannte C=C-Doppelbindung:
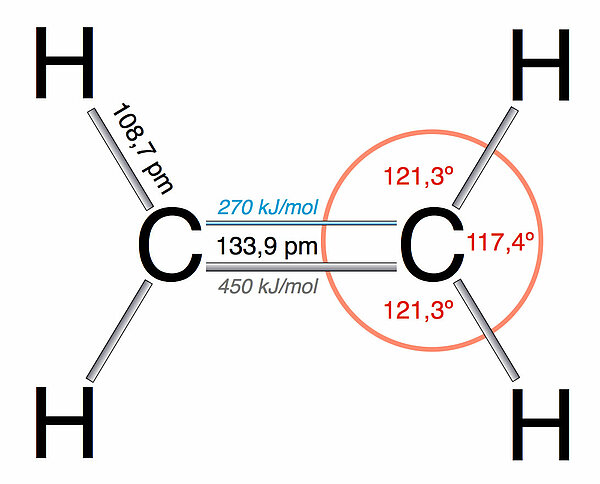
Die C=C-Doppelbindung besteht aus zwei einzelnen Bindungen, einer starken sigma-Bindung und einer schwachen pi-Bindung. Wie man auf der Zeichnung gut erkennen kann, kann die pi-Bindung leicht gespalten werden (nur 270 kJ/mol notwendig). Zur Spaltung der sigma-Bindung braucht man schon deutlich mehr Energie.
Die Bindungswinkel im Ethen-Molekül betragen rund 120 º, mit leichten Abweichungen. Das ganze Molekül ist planar, alle Atome liegen also in einer Ebene.
Physikalische Eigenschaften
Ethen ist ein farbloses, geruchloses und leicht betäubend wirkendes brennbares Gas. Der Schmelzpunkt liegt bei -169,1 ºC, der Siedepunkt bei -103,7 ºC. Die Wasserlöslichkeit kann vernachlässigt werden, in unpolaren Lösemitteln ist Ethen dagegen sehr gut löslich ("Gleiches löst Gleiches"). Ethen hat ähnliche physikalische Eigenschaften wie Ethan, das liegt hauptsächlich daran, dass auch die Ethen-Moleküle nur sehr schwache intermolekulare Anziehungskräfte besitzen.
Chemische Eigenschaften
Elektrophile Addition
Die C=C-Doppelbindung bestimmt die chemischen Eigenschaften des Ethens. Die Doppelbindung ist wegen der hohen Elektronendichte Angriffsziel von elektrophilen Teilchen. Darunter versteht man Atome, Ionen oder Moleküle, die positiv geladen sind oder eine positive Teilladung tragen und "auf der Suche" nach elektronenreichen Reaktionspartnern sind. Protonen gehören beispielsweise dazu.
Oxidation / VerbrennungAndere wichtige Reaktionen des Ethens sind natürlich seine Oxidation; unter ausreichender Sauerstoffzufuhr verbrennt Ethen sauber zu Wasser und Kohlendioxid und liefert dabei recht viel Wärmeenergie:
$H_{2}C=CH_{2} + 3 O_{2} \to 2 CO_{2} + 2 H_{2}O$ mit $\Delta H = -1411 kJ/mol$
Da hier eine C=C-Doppelbindung gespalten werden muss, ist die Energiebilanz nicht ganz so günstig wie bei der Verbrennung von Ethan ($\Delta H = -1560 kJ/mol$).
PolymerisationViele einfache Alkene sind Bausteine für wichtige Kunststoffe. Der weltweit am meisten produzierte Kunststoff, das Polyethylen, wird aus dem Ethen hergestllt. Einzelheiten dazu siehe die Seite über Polyethylen.