Eine starke Lewis-Base ist übrigens nicht automatisch ein starkes Nucleophil. Beide Begriffe, Nucleophilie und Basizität, bezeichnen unterschiedliche Aspekte. Während die Nucleophilie ein kinetisches Maß für die Geschwindigkeit ist, mit der ein Nucleophil ein positives oder positiv polarisiertes C-Atom angreift, ist die Basizität eine thermodynamische Größe, welche die Lage des Gleichgewichts beschreibt, das sich ergibt, wenn eine Base ein Proton anlagert. Es gibt starke Basen, die auch starke Nucleophile sind, es gibt aber auch starke Basen, die schwache Nucleophile sind. Umgekehrt können schwache Basen starke Nucleophile sein.
Als Beispiel sollen einmal das Phenolat-Ion, das Bromid-Ion und das Thiophenolat-Ion dienen.
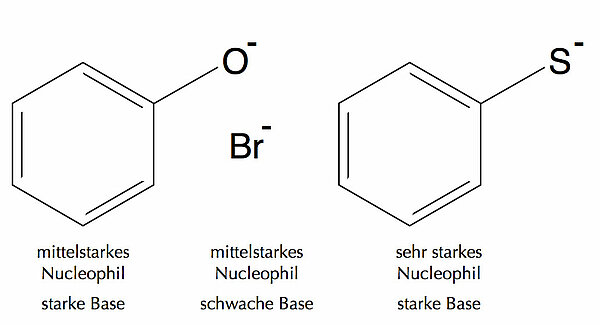
Das Phenolat-Ion und das Bromid-Ion sind beides mittelstarke Nucleophile, unterscheiden sich aber in ihrer Basizität. Phenol ist eine schwache Säure, folglich ist die konjugierte Base, das Phenolat-Ion, eine starke Base.
Warum Phenol eine schwache Säure ist, darf man eigentlich gar nicht fragen. Man sollte vielmehr fragen, wieso Phenol überhaupt eine Säure ist. Normalerweise gibt die OH-Gruppe in organischen Verbindungen ja kein Proton ab. Die Carbonsäuren bilden hier eine Ausnahme, weil die OH-Gruppe in die COOH-Gruppe integriert ist. Aber Alkohole wie Ethanol sind an sich nicht sauer. Die Frage ist also, wieso gibt Phenol überhaupt ein Proton ab? Der Grund ist die Stabilität des Phenolat-Ions. Dieses Ion wird durch mesomere Effekte stabilisiert. Die negative Ladung verteilt sich über den ganzen Benzolring. Phenol ist also eine Säure, aber eine sehr schwache. Daher ist des Phenolat-Ion eine sehr starke Base.
Bromwasserstoff ist eine starke Säure, also ist das konjugierte Bromid-Ion eine schwache Base.
Das Thiophenolat-Ion ist ein Beispiel für ein sehr starkes Nucleophil, das auch gleichzeitig eine ziemlich starke Base ist. Diese Daten habe ich übrigens dem guten alten Lehrbuch "Organische Chemie, ein weiterführendes Lehrbuch" von Carey und Sundberg entnommen [1]. Auch die folgenden Ausführungen habe ich aus diesem tollen Lehrbuch extrahiert.
Faktoren, die die Nucleophilie beeinflussen
Solvationsenergie des Lösemittels
Ein Nucleophil ist entweder negativ geladen oder hat zumindest einen Abschnitt im Molekül, der negativ polarisiert ist. Solche negativen Bereiche im Molekül ziehen polare Lösemittel-Moleküle an. Man denke nur an die Hydrathüllen, die sich bilden, wenn man Bromid-Ionen in Wasser löst. Bevor nun ein Nucleophil sich an ein positiv polarisiertes C-Atom anlagern kann, muss die Hydrathülle oder allgemein Hülle aus Lösemitteln "gesprengt" werden.
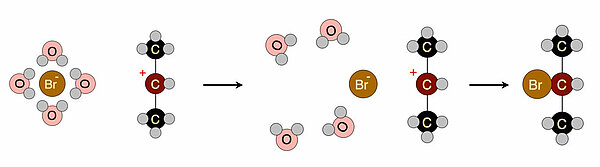
Auf diesem Bild sehen wir das Bromid-Ion, das von einer Hydrathülle umgeben ist, und ein sekundäres Carbenium-Ion. Bevor das Bromid-Ion das Carbenium-Ion als Nucleophil angreifen kann, muss erst die Hydrathülle "gesprengt" werden, welche das Bromid-Ion umgibt. Da es auch viele andere Lösemittel gibt und nicht nur Wasser, spricht man allgemein von der Solvathülle, die aufgebrochen werden muss. Die dazu notwendige Energie wird als Desolvatisierungsenergie bezeichnet. Diese Desolvatisierungsenergie ist mitverantwortlich für die Aktivierungsenergie des zweiten Schrittes der SN1-Reaktion. Je größer die Desolvatisierungsenergie, desto höher die Aktivierungsenergie des zweiten Schrittes und desto langsamer dieser zweite Schritt, was aber nicht unbedingt ins Gewicht fällt, weil ja der erste Schritt der SN1 der geschwindigkeitsbestimmende Schritt ist. Bei der SN2-Reaktion dagegen greift das Nucleophil die R-X-Verbindung direkt in einem Schritt an. Hier spielt die Desolvatisierungsenergie eine deutlich wichtigere Rolle als bei der SN1-Reaktion.
Stärke der neuen R-Y-BindungWenn das Nucleophil Y in der SN2-Reaktion die Verbindung R-X angreift, entsteht eine neue Bindung, nämlich die R-Y-Bindung. Wenn diese stärker ist als die alte R-X-Bindung, bildet sich ein recht stabiler Übergangszustand, was die Aktivierungsenergie dieses einen Schrittes senkt. Die Bindungsenergie R-Y ist also ein entscheidender Faktor für die Stärke eines Nucleophils. Je größer diese Bindungsenergie, desto schneller verläuft die Substitution. Da die Nucleophilie einer Base eine kinetische Größe ist, sich also auf die Reaktionsgeschwindigkeit bezieht, kann man also sagen, dass die Höhe der Bindungsenergie R-Y sich direkt auf die Nucleophilie von Y auswirkt.
Sterische FaktorenEin kleines Nucleophil kann sich besser an einen Stoff R-X anlagern als ein großes Nucleophil. Wenn große Alkylgruppen am nucleophilen Zentralatom "hängen", dann wird sowohl die SN2- wie auch der zweite Schritt der SN1-Reaktion sterisch (räumlich) behindert.
Elektronegativität des NucleophilsEin stark elektronegatives Nucleophil, beispielsweise das Fluorid-Ion, bindet seine Außenelektronen viel stärker an sich als ein weniger stark elektrophiles Nucleophil, zum Beispiel das Bromid-Ion. Bei der SN2-Reaktion müssen die Elektronen des freien Elektronenpaars der Base aber zum positiven oder positiv polarisierten C-Atom "hinüber rutschen". Sind diese Elektronen stark an das Nucleophil gebunden, so ist dieser Vorgang erschwert. Je elektronegativer also das Zentralatom des Nucleophils, desto schwächer das Nucleophil.
Polarisierbarkeit des NucleophilsEng verwandt mit dem vorherigen Faktor Elektronegativität ist die Polarisierbarkeit der Lewis-Base, die als Nucleophil das C-Atom angreift. Sind die Außenelektronen des Nucleophils weit vom Atomkern entfernt, sitzen sie "recht locker", sind also nicht so stark gebunden und können dann beim Übergangszustand der SN2-Reaktion leicht an das C-Atom abgegeben werden. Daher ist das Bromid-Ion ein stärkeres Nucleophil als das Chlorid-Ion. Das Bromid-Ion ist "weicher" bzw. leichter polarisierbar als das Chlorid-Ion.
Das Trimethylphosphin P(CH3)3 reagiert in Methanol als Lösemittel schneller als das analoge Trimethylamin N(CH3)3. Eine der Ursachen dafür ist die Größe des Phosphor-Atoms, dadurch ist das Phosphin leichter polarisierbar als das Amin[3].
Messung der Nucleophilie
Den Grad der Nucleophilie kann man nicht direkt messen, Nucleophilie ist keine Größe wie Elektronegativität, Leitfähigkeit, Siedepunkt oder pH-Wert. Man kann nur die relative Nucleophilie im Vergleich zu einem Referenz-Nucleophil messen. Laut [1] dient Methanol als Referenz-Nucleophil. Außerdem muss man eine Referenz-Verbindung R-X wählen. Das Iodmethan CH3I ist eine solche Referenz-Substanz. Man gibt einfach verschiedene Nucleophile zu Iodmethan und misst die Geschwindigkeit, mit der die nucleophile Substitution abläuft. Dann wird diese Geschwindigkeit verglichen mit der Geschwindigkeit, mit der Methanol mit Iodmethan reagiert.
Wenn man dem Referenz-Nucleophil Methanol den willkürlichen Wert 1 zuordnet, dann ist das Fluorid-Ion 500 mal nucleophiler, das Acetat-Ion 20.000 mal, das Chlorid-Ion 23.000 mal, das Ammoniak-Molekül 316.000 mal, das Bromid-Ion 617.000 mal das Cyanid-Ion gut 5.000.000 mal und das Iodid-Ion gut 26.000.000 mal [2].
| Nucleophil | relative Nucleophile |
| CH3OH | 1 |
| NO3- | 32 |
| F- | 500 |
| CH3COO- | 20.000 |
| Cl- | 23.000 |
| NH3 | 316.000 |
| Br- | 617.000 |
| CN- | 5.010.000 |
| I- | 26.300.000 |
In seiner Organik-Vorlesung[3] hat Prof. Dyker folgende Reaktivitätsreihenfolge für Nucleophile aufgestellt. Gemessen wurde die Reaktionsgeschwindigkeit der Substitution von Brom-methan in einer wässrigen Lösung; eine Temperatur wurde dabei nicht genannt.
| Nucleophil | relative Nucleophile |
| H2O | 1 |
| CH3COO- | 500 |
| NH3 | 700 |
| OH- | 16.000 |
| I- | 100.000 |
| CN- | 125.000 |
| HS- | 130.000 |
Quellen:
- Carey, Sundberg: Organische Chemie - einweiterführendes Lehrbuch, Weinheim 1995.
- Vollhardt, Schore: Organische Chemie, Weinheim 2011
- Vorlesung Organische Chemie, Prof. Dyker 2012, Ruhr-Universität Bochum