Ein Methan-Molekül ist tetraederförmig
Ein Methan-Molekül besteht aus einem Kohlenstoff-Atom, das von vier Wasserstoff-Atomen umgeben ist. Räumlich muss man sich das so vorstellen, dass sich die vier H-Atome in den vier Ecken eines Tetraeders befinden und das C-Atom in der Mitte des Tetraeders.
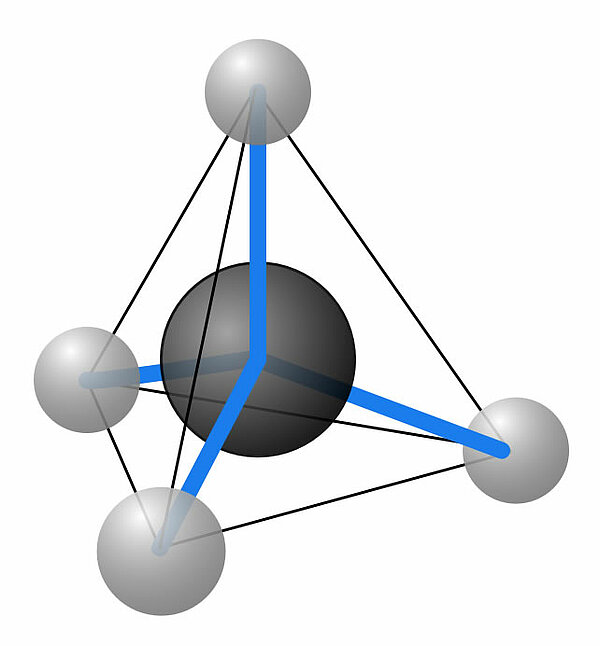
Diese Tetraederstruktur kann experimentell nachgewiesen werden, auf die Einzelheiten soll hier aber nicht eingegangen werden. Man hat jedenfalls herausgefunden, dass alle vier H-Atome gleich weit voneinander entfernt sind. Hätte das Methan eine planare Struktur, wie im folgenden Bild zu sehen...
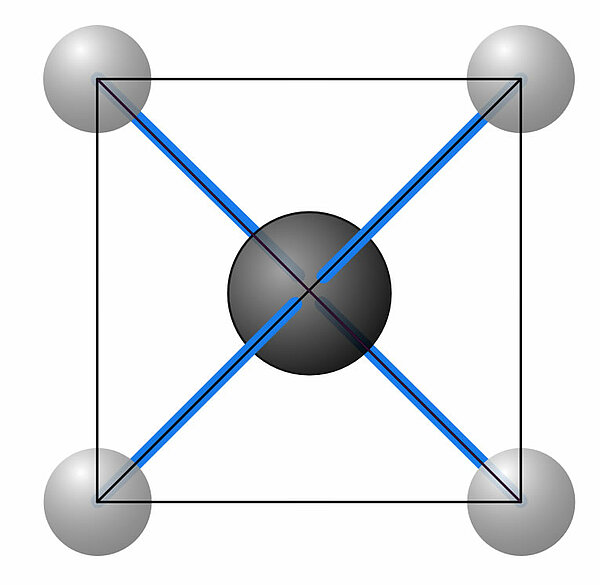
...dann wären die nebeneinander liegenden H-Atome näher beieinander als die diagonal gegenüberliegend. Man müsste also zwei verschiedene H-H-Abstände im Molekül messen können.
Strukturdaten des Methan-Moleküls
Dieser Abschnitt wurde nur der Vollständigkeit halber ergänzt; für den Chemie-Unterricht muss man sich die folgenden Strukturdaten natürlich nicht merken.
Die vier H-Atome des Methans sind tetraedrisch angeordnet, der Bindungswinkel H-C-H beträgt also jeweils 109,5º. Die vier C-H-Bindungen sind relativ unpolar, da der EN-Unterschied zwischen Kohlenstoff (2,55) und Wasserstoff (2,20) recht klein ist. Die Bindungslänge der C-H-Bindungen beträgt 108,80 pm, und die Bindungsdissoziationsenergie liegt bei 411 kJ/mol, wobei das nur ein Durchschnittswert ist; zur Abspaltung des ersten H-Atoms sind beispielsweise 421 kJ/mol notwendig.
Begründung der Struktur
In diesem Abschnitt geht es nicht um die Frage, wie man die Struktur und die Strukturdaten des Methan-Moleküls herausbekommen hat, sondern wie man begründen kann, warum das Methan-Molekül eine Tetaederstruktur hat. Die Antwort auf diese Frage sollte jeder Schüler eines Chemie-Grundkurses auswendig kennen.
Die tetraederförmige Struktur des Methan-Moleküls liegt im Aufbau des Kohlenstoff-Atoms begründet. Nach dem Kugelwolkenmodell hat das C-Atom vier einfach besetzte Kugelwolken, die das innere Atome (also den Atomkern mit den beiden Elektronen der K-Schale) tetraederförmig umgeben. Der Grund für die tetraederförmige Anordnung der vier Elektronenwolken ist die gegenseitige Abstoßung dieser Wolken. Elektronen sind bekanntlich negativ geladen, und daher sind auch die vier Elektronenwolen negativ geladen. Negative Ladungen stoßen sich aber gegenseitig ab. Die Kugelwolken versuchen sich so weit wie möglich voneinander zu entfernen. Eine planare Anordnung der Kugelwolken, so ähnlich wie in Abbildung 2, ist ungünstig, denn dann wäre der Abstand zwischen zwei benachbarten Kugelwolken nicht maximal. Den maximalen Abstand finden alle vier Kugelwolken, wenn sie sich so anordnen, dass sie in den vier Ecken eines Tetraeders liegen.
Das ist der Grund, warum die Kugelwolken des C-Atoms tetraederförmig angeordnet sind, und das ist schließlich auch der Grund, warum das Methan-Molekül tetraederförmig aufgebaut ist. Jede der vier Kugelwolken ist mit einem Elektron besetzt. Mit vier H-Atomen bilden diese vier Kugelwolken nun unpolare kovalente Bindungen, und es ist klar, dass auch diese mit zwei Elektronen besetzten kovalenten Bindungen möglichst weit voneinander entfernt sein "wollen". Daher überträgt sich die tetraederförmige Anordnung der Kohlenstoff-Kugelwolken auf das Methan-Molekül.