Vereinfacht ausgedrückt versteht man unter Hyperkonjugation das "Herüberspringen" von Elektronen aus einem doppelt besetzten Orbital in ein leeres oder einfach besetztes benachbartes Orbital.

Hier sehen wir ein Ethyl-Radikal *CH2CH3; das radikalische C-Atom (links) ist sp2-hybridisiert, und in dem pz-Orbital befindet sich nur ein Elektron, was natürlich ein instabiler Zustand ist. In der Nachbarschaft dieses p-Orbitals befinden sich aber doppelt besetzte bindende sp3-Orbitale. Dieses Orbital kann nun mit dem pz-Orbital überlappen, wodurch die Elektronendichte in dem p-Orbital erhöht wird.
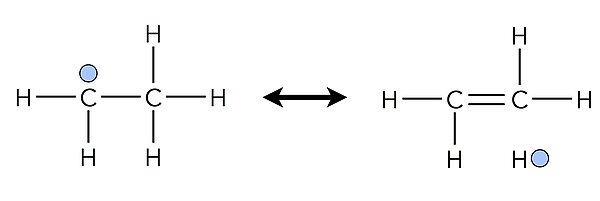
Die obige Abbildung stellt die Hyperkonjugation beim Ethyl-Radikal mit Hilfe von zwei Grenzformeln dar. Zusammen bilden diese Grenzformeln eine sogenannte no-bond-Resonanzstruktur: Zwischen dem einen H-Atom und dem Molekül besteht keine kovalente Bindung mehr. Neben den beiden gezeigten Grenzstrukturen existieren weitere Grenzstrukturen des Ethyl-Radikals, die hier aber nicht dargestellt sind.
Die Hyperkonjugation ist nun ein wichtiger Faktor, der zur Stabilisierung von Radikalen und Carbenium-Ionen beiträgt. Je mehr doppelt besetzte bindende Orbitale oder freie Elektronenpaare in der Nähe eines einfach besetzten oder gar leeren p-Orbitals sind, desto größer die Wahrscheinlichkeit, dass ein Elektron in dieses p-Orbital "hineinspringt". Daher sind sekundäre Alkylradikale stabiler als primäre, und tertiäre sind stabiler als sekundäre - das gilt noch mehr für Carbenium-Ionen mit ihrem leeren pz-Orbital.
Für Experten:
Laut Lexikon der Chemie ist das Ethyl-Kation gegenüber dem Methyl-Kation durch Hyperkonjugation um 150 kJ/mol stabiler.
Didaktische Anmerkung:
Schülern der Sek. II "verkauft" man diese Art der Hyperkonjugation gern als positiven induktiven Effekt oder +I-Effekt, man sagt dann einfach, dass die Alkylgruppen Elektronen "schieben" und so die Elektronen- oder Ladungsdichte erhöhen können.