Rhodospin oder "Sehpurpur" ist das lichtempfindliche Protein in den Sehzellen (Stäbchen) der Netzhaut von Wirbeltieren. Das "Protein" Rhodopsin besteht aus zwei Komponenten: Dem eigentlichen Protein Opsin, und dem Chromophor ("Farbträger") 11-cis-Retinal, einer niedermolekularen organischen Verbindung mit leicht orange-rötlicher Farbe.
Chromophor 11-cis-Retinal
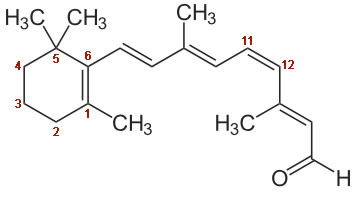
Hier sehen wir die Strukturformel von 11-cis-Retinal, man achte auf die C=C-Doppelbindung zwischen dem C-Atom 11 und dem C-Atom 12. Diese Doppelbindung liegt in der cis-Form vor, daher hat dieser Aldehyd seine Bezeichnung.
Wenn das 11-cis-Retinal Licht absorbiert, ändert es seine Struktur: aus der cis-Doppelbindung zwischen C-Atom 11 und 12 wird eine trans-Doppelbindung; entsprechend müsste das Reaktionsprodukt eigentlich 11-trans-Retinal heißen. Da nun aber alle C=C-Doppelbindungen in der trans-Form vorliegen, wird das Produkt auch als all-trans-Retinal bezeichnet.
Proteinkomponente Opsin
Es gibt zwei verschiedene Opsine in der Wirbeltier-Netzhaut, nämlich die Stäbchen-Opsine und die Zapfen-Opsine. Als Rhodopsin wird aber nur die Kombination aus Stäbchen-Opsin und 11-cis-Retinal bezeichnet. Die Kombination Zapfen-Opsin und 11-cis-Retinal wird dagegen als Iodopsin bezeichnet.
Chemisch betrachtet sind beide Opsine große Transmembran-Proteine, also Proteine, die sich durch die gesamte Lipid-Doppelschicht ziehen. Genauer gesagt, handelt es sich um heptahelicale Transmembran-Proteine, also um Proteine, die sieben (hepta) alpha-Helices besitzen, mit denen sie in der Membran verankert sind.
Bei den Stäbchen befindet sich das Rhodopsin in den Membranen der Discs, also der scheibenförmigen Strukturen im Außensegment der Photorezeptoren. Laut Wikipedia bestehen 90% der Membranproteine der Discs aus Rhodopsin.
Das Rhodopsin kann in zwei verschiedenen Konformationen vorliegen. Im Dunklen liegt das Rhodopsin in der "passiven" Konformation vor, und wenn das 11-cis-Retinal belichtet wird (wozu oft schon ein einziges Photon ausreicht) und in die all-trans-Form übergeht, ändert das Rhodopsin seine Konformation und wird "aktiv". Das "aktive" Rhodopsin kann nun eine Reaktionskaskade auslösen, bei der weitere Proteine beteiligt sind. Am Ende dieser Reaktionskaskade steht dann die Depolarisierung des Photorezeptors und die Ausschüttung von Neurotransmittern - könnte man meinen. In Wirklichkeit ist es etwas komplizierter. Lesen Sie dazu bitte den Artikel "Der Sehprozess" auf meiner Homepage.