Kohlenhydrate, Fette und Eiweiße bestehen aus teils komplexen organischen Molekülen. Jede einzelne C-C-Bindung, jede C-H-Bindung und jede andere in den Molekülen vorkommende chemische Bindung enthälte eine gewisse Energiemenge, die sogenannte Bindungenergie. Bei der Verdauung der Nährstoffe (abbauender Stoffwechsel) werden diese chemischen Bindungen zum größten Teil "gesprengt", und die in den Bindungen steckende Energie wird freigesetzt. Zum Teil wird diese Bindungsenergie direkt in Wärmeenergie umgewandelt (Körperwärme, typisch für gleichwarme Tiere) oder in Bewegungsenergie (Muskeln, Zellbewegung etc.), zum Teil wird sie aber von den Zellen unseres Körpers genutzt, um chemische Verbindungen aufzubauen, die unser Körper benötigt, zum Beispiel Proteine, Nucleinsäuren und so weiter (aufbauender Stoffwechsel).
Energiegehalt
Den Energiegehalt eines Stoffes misst man in Joule bzw. dem Tausendfachen davon, in Kilojoule, abgekürzt kJ. Die Definition des Begriffs "Joule" ist reichlich physikalisch und nicht ganz leicht zu verstehen; besser ist hier die Definition der schon lange veralteten aber immer noch oft benutzten Energieeinheit Kalorie cal bzw. Kilokalorie kcal.
1 Kilokalorieist die Energiemenge, die man benötigt, um 1 Liter bzw. 1 kg Wasser von 14,5 ºC auf 15,5 ºC zu erwärmen.
Diese Definition ist recht leicht zu verstehen, zumal sie auch die Grundlage der Energiemessung von Nährstoffen und anderen chemischen Verbindungen ist.
Die Temperaturangabe "von 14,5 ºC auf 15,5 ºC" ist wichtig, weil "sich die zur Erwärmung von je 1 g Wasser nötigen Wärmemengen bei höheren oder niedrigeren Temperaturen etwas ändern" (Römpp Chemie Lexikon, Stichwort "Kalorie").
Was man sich dann noch merken muss, ist die folgende kurze Definition:
1 kcal = 4,184 kJ
Für das tägliche Leben reicht es auch aus, wenn man sich den Faktor 4,2 merkt, 1 kcal = 4,2 kJ.
Kalorimeter
Wie misst man nun den Energiegehalt eines Lebensmittels? In ein Gerät, das den leicht zu merkenden Namen Kalorimeter trägt, gibt man eine genau abgewogene Menge des Nährstoffs, zum Beispiel 0,1 g Glucose. In einer komplett von Wasser umgebenen Kammer wird dieser Nährstoff dann verbrannt. Damit das leichter geht, ist diese Kammer mit reinem Sauerstoff gefüllt. Ein einziger Funke der elektrischen Zündung reicht, und der Nährstoff brennt. Die bei dieser vollständigen Verbrennung freigesetzte Reaktionsenergie wird in das umgebende Wasser geleitet. Und dann macht man sich die Definition der Kalorie zunutze. Man misst genau, wie stark sich das Wasser durch diese Verbrennung erwärmt. Wie diese Berechnung genau funktioniert, muss uns hier nicht weiter interessieren. Das Grundprinzip sollte jetzt jedoch klar geworden sein.
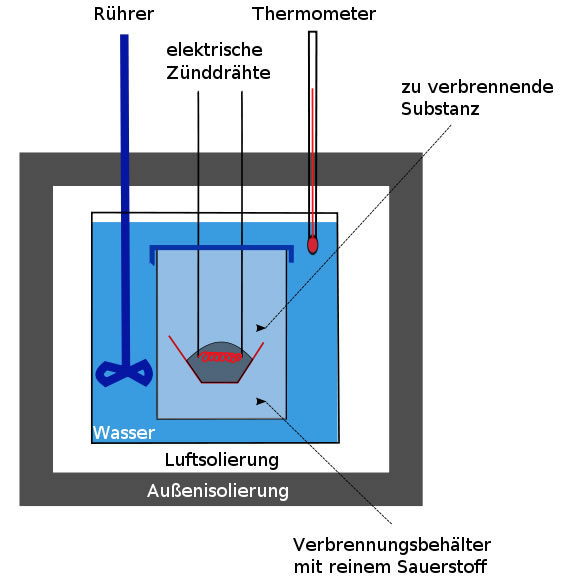
Physikalische Brennwerte
Wenn man 1 g Kohlenhydrat in einem solchen Kalorimeter verbrennt, kann man eine Energieabgabe von genau 17,2 kJ messen. Bei 1 g Eiweiß (Protein) erhält man 23,4 kJ, und bei 1 g Fett sogar 38,9 kJ. Fett ist von den drei Nährstoffen also der energiereichste.
Physikalischer Brennwert = die Energiemenge, die bei der Verbrennung von 1 g der Verbindung freigesetzt wird.
Bei diesen Werten handelt es sich natürlich um Durchschnittswerte, die in vielen Hundert Einzelversuchen ermittelt worden sind. Die Brennwerte der verschiedenen Kohlenhydrate unterscheiden sich leicht voneinander, ebenso die Brennwerte der verschiedenen Eiweiße und Fette. Alkohol hat ebenfalls einen nicht zu vernachlässigenden Brennwert, nämlich 29,0 kJ/g.
Physiologische Brennwerte
In den Nährwerttabellen, in denen man so gerne nachschaut, ob man sich das Stück Torte noch leisten kann, sind ebenfalls Brennwerte für die Lebensmittel angegeben. Allerdings findet man hier nicht die physikalischen Brennwerte, sondern die physiologischen Brennwerte. Die physiologischen Brennwerte sind stets geringer als die physikalischen, weil bei der Verwertung der aufgenommenen Nahrung immer Verluste entstehen, teils durch die Kotbildung, teils durch die Harnbildung, teils durch die Entstehung von Wärme bei der Verdauung. Einzelheiten hierzu siehe "Stufen der Energieverwertung".
Bei Kohlenhydraten und Fetten entsprechen die physiologischen Brennwerte ungefähr den physikalischen. Die Zellen unserers Körpers verbrennen Kohlenhydrate und Fette nahezu vollständig zu Kohlendioxid und Wasser - ähnlich wie bei der Verbrennung in einem Kalorimeter.
Bei den Proteinen sieht es aber etwas anderes aus. Proteine werden nicht zu 100% zu Kohlendioxid und Wasser verbrannt, sondern bei der Oxidation der Proteine entstehen auch andere organische Verbindungen, die selbst noch einen gewissen Brennwert haben. Schuld daran ist vor allem der Stickstoff, der in den Aminosäuren der Proteine enthalten ist; Stickstoff kann nicht so leicht oxidiert werden.
Der physiologische Brennwert von Proteinen ist also geringer als der physikalische Brennwert. Im Kalorimeter werden Proteine zu 100% verbrannt, im menschlichen Körper aber nicht. Der physiologische Brennwert von Proteinen liegt daher bei 17 kJ/g, also ungefähr in der Größenordnung der Kohlenhydrate.
Physiologische Brennwerte
- Kohlenhydrate: 17,2 kJ/g
- Proteine: 17,2 kJ/g
- Fette: 38,9 kJ/g
Diese Werte sollte man am besten auswendig lernen, sie werden bei der Analyse von Lebensmitteln und Tagesplänen immer wieder benötigt.
Die Hölle des Gummibären
Den Brennwert von Lebensmitteln kann man sehr schön mit dem eindrucksvollen Versuch "Die Hölle des Gummibären" demonstrieren, von dem es auf YouTube jede Menge Videos gibt. Besonders gut gefallen hat mir dieses Video.
Zum Versuch: Ein schwer schmelzbares Reagenzglas wird mit Kaliumchlorat gefüllt (ca. 2 cm hoch), welches dann mit dem Brenner zum Schmelzen gebracht wird (Abzug, Schutzscheibe, kann sehr gefährlich sein!). Ist das Kaliumchlorat flüssig, wird ein Gummibärchen in das Reagenzglas gegeben.
Nach einer kurzen Verzögerung von vielleicht 1 Sekunde beginnt eine sehr heftige chemische Reaktion (siehe Video), bei der extrem viel Verbrennungswärme abgegeben wird.