Voraussetzungen
Wenn Sie diese Seite erfolgreich durcharbeiten wollen, sollten Sie folgende Kenntnisse haben:
- grundlegender Ablauf der SN1-Reaktion.
Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- dass auch primäre Alkohole eine SN1-Reaktion durchlaufen, wenn eine Säure die Reaktion katalysiert,
- dass diese Reaktion in drei Schritten abläuft,
- wie diese drei Schritte aussehen,
- wie man das Energiediagramm einer SN1-Reaktion zeichnet und erklärt.
Hier wird der säurekatalysierte Mechanismus der Bromierung von Ethanol besprochen, einem Versuch, den ich früher immer als Schülerversuch in der Stufe Q1 durchführen ließ, nach der Beschreibung in dem alten DDR-Buch "Chemische Schulexperimente" von JUST und HRADETZKY. Bei diesem Versuch, der nach den heutigen Sicherheitsbestimmungen in der Schule nicht mehr durchgeführt werden darf, weil das Reaktionsprodukt zu gefährlich ist, werden 3 ml Ethanol mit 3 g Kaliumbromid und 3 ml konz. Schwefelsäure in einem Reagenzglas erhitzt. Die Dämpfe werden gekühlt und kondensieren dann in einem zweiten wassergekühlten Reagenzglas. Das Reaktionsprodukt tropft in Form dicker milchiger Tropfen in das gekühlte Reagenzglas.

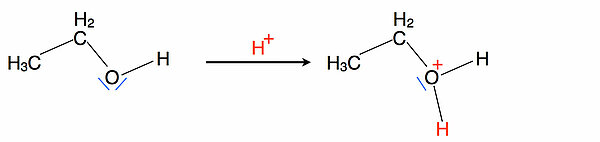
Im ersten Schritt spaltet die Schwefelsäure ein Proton ab, welches sich dann an das O-Atom des Alkohols setzt. Es entsteht ein Oxonium-Ion mit einem positiv geladenem dreibindigen O-Atom - ein äußerst instabiler Zustand, der dann in den Schritt 2 überleitet.
Schritt 2Der zweite Reaktionsschritt besteht in der Abgabe eines Wasser-Moleküls. Wasser ist aus energetischer Sicht eine sehr stabile Verbindung. Viele chemische Reaktionen finden nur deswegen statt, weil dabei Wasser freigesetzt wird. Man denke hier an die zahlreichen Kondensationsreaktionen, die man aus der Biologie und Biochemie kennt (Bildung von Peptiden aus Aminosäuren, Entstehung von Zweifach- und Viefachzuckern aus Monosacchariden, Bildung von Fettmolekülen aus Glycerin und Fettsäuren etc.).
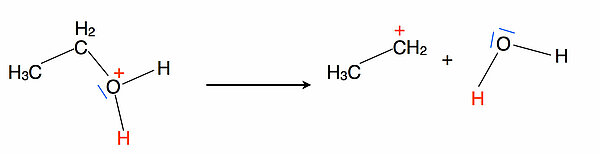
Im zweiten Schritt bildet sich ein primäres Carbenium-Ion, also ein sehr instabiles Zwischenprodukt.
Schritt 3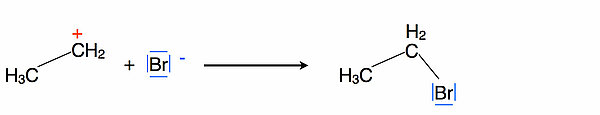
Im dritten Reaktionsschritt lagert sich als Nucleophil ein Bromid-Ion an das Carbenium-Ion an. Es entsteht nur ein Reaktionsprodukt, da das Carbenium-C-Atom nicht chiral ist (es hat nicht drei verschiedene Substituenten, sondern nur zwei verschiedene, nämlich eine Methylgruppe und zwei H-Atome).
FazitAn sich würde ein primärer Alkohol wie Ethanol nicht nach dem SN1-Mechanismus mit einem Nucleophil reagieren. Das primäre Carbenium-Ion, das als Zwischenprodukt entsteht, ist sehr instabil. Tertiäre Carbenium-Ionen sind viel stabiler, und daher reagieren tertiäre Alkohole oder Halogenalkane bevorzugt nach dem SN1-Mechanismus, nicht aber primäre Alkohole oder Halogenalkane.
Dass der Alkohol trotzdem nach dem SN1-Mechanismus reagiert, liegt an dem Einfluss der Säure. Durch die Protonierung der OH-Gruppe im ersten Schritt wird eine Situation geschaffen, die nur durch die Abspaltung eines Wasser-Moleküls entschärft werden kann. Dabei entsteht zwangsläufig ein Carbenium-Ionen, und somit ist der SN1-Mechanismus festgelegt.
Energiebetrachtungen
Auf diesem Bild sehen wir das Energiediagramm einer SN1-Reaktion[2]. Das Edukt R-X reagiert mit einem anionischen Nucleophil Y- zum Produkt R-Y.
Der erste Reaktionsschritt hat eine recht hohe Aktivierungsenergie EA1. Die Aktivierungsenergie ist so hoch, weil eine Bindung gespalten werden muss.
Als Zwischenprodukt entsteht ein planares Carbenium-Ion. Dieser Zustand ist energetisch recht ungünstig, was man an der erhöhten Energie des Zwischenproduktes sehen kann.
Der zweite Reaktionsschritt besteht in der Bildung einer neuen Bindung. Daher ist hier die Aktivierungsenergie EA2 recht niedrig. Außerdem ist der zweite Schritt stark exotherm, auch vor allem deshalb, weil eine neue Bindung entsteht.
Wegen der hohen Aktivierungsenergie des ersten Schrittes verläuft dieser langsam, während der zweite Schritt sehr schnell abläuft. Bei mehrschrittigen Reaktionen ist die Geschwindigkeit der Gesamtreaktion stets von der Geschwindigkeit der langsamsten Teilreaktion abhängig. Da der langsamste und somit geschwindigkeitsbestimmende Schritt eine Reaktion 1. Ordnung ist, ist auch die Gesamtreaktion eine Reaktion 1. Ordnung.
Allerdings ist die Gesamtreaktion keine "richtige" monomolekulare Reaktion, sondern eine pseudomonomolekulare Reaktion - es sind ja immer noch zwei Edukte an der Reaktion beteiligt. Die Kinetik der Gesamtreaktion ist aber monomolekular.
Aufgaben
Aufgabe 1
Zeichnen Sie zunächst die Strukturformeln folgender Brom-Alkane:
Brommethan, Bromethan, 1-Brompropan, 1-Brom-2-methyl-propan, 1-Brom-2,3-dimethyl-propan.
Achtung: Es könnte durchaus sein, dass einer dieser Namen nicht korrekt ist. Zeichnen Sie das Molekül dann trotzdem und schreiben Sie den korrekten Namen darunter.
Aufgabe 2Versetzt man diese Bromalkane mit Ethanolat-Ionen (CH3-CH2-O-), so kommt es zu einer nucleophilen Substitution. Zeichnen und benennen Sie die organischen Reaktionsprodukte.
Aufgabe 3Primäre Halogenalkane gehen bevorzugt eine Reaktion nach dem SN2-Mechanismus ein, weil primäre Carbenium-Ionen, die sich beim SN1-Mechanismus bilden würden, sehr instabil sind. Trotzdem reagieren einige der obigen Edukte nach dem SN1-Mechanismus. Überlegen Sie, welche der oben genannten Brom-Alkane das sein könnten und finden Sie eine Begründung für dieses Verhalten.
Aufgabe 4Wenn man Reaktionsbedingungen schafft, die einen SN1-Mechanismus ausschließen, findet man bei der Umsetzung der Bromalkane mit Ethanolat-Ionen folgende relative Reaktionsgeschwindigkeiten [4]:
- Brommethan = 100
- Bromethan = 6
- 1-Brompropan = 2
- 1-Brom-2-methyl-propan = 0,2
- 1-Brom-2,2-dimethyl-propan = 0,00002
Begründen Sie, wieso das so ist.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Morrison/Boyd, Organic Chemistry, 7th Edition, 2011
- Carey/Sundberg, Organische Chemie - ein weiterführendes Lehrbuch, Weinheim 1995
- Morrison/Boyd, Lehrbuch der organischen Chemie, Weinheim 1974, S. 514.