Addition von H2 an Alkene
Die denkbar einfachste elektrophile Addition ist sicherlich die Addition von elementarem Wasserstoff an die C=C-Doppelbindung, die sogenannte Hydrierung (nicht zu verwechseln mit der Hydratisierung, der Addition von Wasser).
Die Addition von Wasserstoff an ein Alken führt allgemein zu dem entsprechenden Alkan; aus Buten wird zum Beispiel Butan.
Die Hydrierung wird oft für Analysen eingesetzt; sie verläuft unter bestimmten Bedingungen quantitativ (d.h. der eingesetzte Wasserstoff wird vollständig an die Doppelbindungen angelagert, es bleibt keine Doppelbindung verschont), daher kann man auf diese Weise leicht die Zahl der Doppelbindungen in einem organischen Molekül bestimmen. So kann man zum Beispiel herausbekommen, wie viele Doppelbindungen eine ungesättigte Fettsäure enthält. Andererseits kann man für bestimmte Synthesen eine Hydrierung aber auch so durchführen, dass nur bestimmte C=C-Doppelbindungen hydriert werden.
Bei den quantitativen Analysen kann man entweder das Volumen des verbrauchten Wasserstoffs messen oder die bei der Hydrierung freigesetzte Wärme, die sogenannte Hydrierungswärme. Die Hydrierung ist nämlich eine exotherme Reaktion, wie man leicht an der Hydrierung von Ethen nachrechnen kann. Die beiden gebildeten C-H-Bindungen haben zusammen eine um ca. 126 kJ/mol größere Bindungsdissoziationsenthalphie als die H-H-Bindung des Wasserstoffs und die pi-Bindung zwischen den beiden C-Atomen zusammen.
Hydrierungswärme
Die Reaktionsenthalpie, die bei der Addition von Wasserstoff an 1 mol des Alkens bzw. der ungesättigten Verbindung freigesetzt wird. Im Schnitt sind das ca. 126 kJ/mol pro C=C-Doppelbindung.
Die Chemgapedia listet auf ihrer Seite "Hydrierung von Alkenen" vier Beispiele mit unterschiedlichen Hydrierungswärmen auf [2]:
- Ethen: 136,9 kJ/mol
- Propen: 125,6 kJ/mol
- trans-2-Buten: 115,6 kJ/mol
- cis-2-Buten: 119,7 kJ/mol
Bei der Hydrierung kann man das Alken nicht einfach mit gasförmigen Wasserstoff in Verbindung bringen. Dann passiert nämlich gar nichts, weil die Aktivierungsenergie der Hydrierung sehr hoch ist. Es werden also spezielle Katalysatoren benötigt, welche die Aktivierungsenergie stark absenken. Dabei unterscheidet man heterogene und homogene Katalyse.
Heterogene HydrierungDie heterogene Katalyse ist das ältere Verfahren. Als Katalysator verwendet man Platin, Palladium oder Nickel [1] auf Aktivkohle [2]. Hydriert man auf diese Weise ein zyklisches Alken wie zum Beispiel Cyclohexen, so stellt man fest, dass die Hydrierung immer eine syn-Addition ist. Das heißt, die beiden H-Atome werden auf der gleichen Seite der Doppelbindung addiert, so dass ein cis-Produkt entsteht.
Wenn man Cyclohexen hydriert, bildet sich das Alkan Cyclohexan. An den beiden C-Atomen der ehemaligen Doppelbindung sitzen dann je zwei H-Atome. Wie kann man dann feststellen, dass eine syn-Addition abgelaufen ist? Die neuen H-Atome sind doch von den bereits vorhandenen in keiner Weise zu unterscheiden?
Hier greift man zu folgendem "Trick": Man verwendet bei der Hydrierung keinen normalen Wasserstoff, sondern Wasserstoff-Moleküle, bei denen beide H-Atome durch Deuterium-Atome ersetzt worden sind. Deuterium ist ein Isotop des Wasserstoffs und enthält im Atomkern neben dem Proton ein Neutron, hat also die Atommasse 2. Mit bestimmten analytischen Methoden kann man nun die genaue räumliche Position der beiden Deuterium-Atome bestimmen, nachdem diese sich an die Doppelbindung gesetzt haben.
Ursache für diese syn-Addition ist die Art und Weise, wie der Katalysator arbeitet. Er bindet nämlich zuerst die beiden H-Atome des Wasserstoff-Moleküls. Vereinfacht gesagt, wird dann das Ethen-Molekül so vom Katalysator gebunden, dass die beiden C-Atome quasi auf die H-Atome draufgesetzt werden.
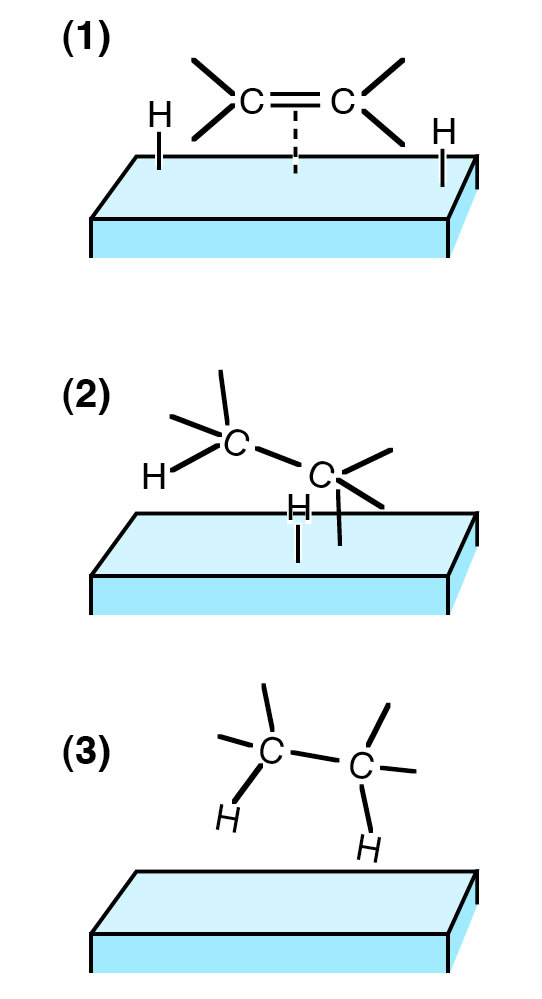
Das ist aber wie bereits gesagt eine sehr stark vereinfachte Darstellung. Eine genauere Darstellung findet sich auf der Seite "Die Platingruppe" der Universität Bayreuth unter dem Abschnitt 1.2 Katalyse.
Homogene HydrierungDieses Verfahren ist moderner als die heterogene Katalyse, und es arbeitet viel selektiver [1]. Die Katalysatoren sind organische Komplexe von Übergangsmetallen wie Rhodium oder Iridium. Das bekannteste Beispiel ist der Wilkinson-Katalysator [4]. Ein Rhodium-Atom ist von drei Phosphor-Atomen und einem Chlor-Atom umgeben. Jedes Phosphor-Atom ist seinerseits mit drei Phenylgruppen (Benzolringen) verbunden. Daher die gewaltige Summenformel C54H45ClP3Rh.
Auf den komplexen Katalyse-Mechanismus gehe ich hier nicht weiter ein (siehe Wikipedia-Artikel). Interessant ist hierbei aber, dass man mit diesem Katalysator ganz gezielt endständige C=C-Doppelbindungen hydrieren kann.
Die organischen Katalysatoren lassen sich leicht in organischen Lösemitteln lösen. Nach vollendeter Hydrierung gibt es dann oft das Problem, den Katalysator vom Endprodukt und vom Lösemittel wieder abzutrennen. Die Lösung dieses Problems führt dann doch wieder zu einer Art heterogener Katalyse: Der organische Katalysator wird an ein Polymer gebunden. Am Ende wird dieses Polymer mit dem Katalysator dann einfach abfiltriert [1].
Quellen:
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Chemgapedia, Artikel "Hydrierung von Alkenen"
- Uni Bayreuth, Didaktik der Chemie, Artikel "Die Platingruppe"
- Wikipedia, Artikel "Wilkinson-Katalysator"
- Römpp Chemie-Lexikon, 9. Auflage 1992