Der Zink-Iod-Akkumulator spielt in der Technik nicht gerade eine bedeutende Rolle, aber er kann sehr schön im Chemie-Unterricht aufgebaut und untersucht werden. Dazu eignet sich folgender Versuch sehr gut.
Versuch: Zink-Iod-Akku
Durchführung:
- Geben Sie in ein Becherglas (250 ml) 10 g Iod und 100 ml Wasser sowie ein paar Spatelspitzen Kaliumiodid.
- Geben Sie zwei bis drei Spatel Zinkpulver hinzu und rühren Sie solange um, bis die Lösung farblos geworden ist. Sollte die Lösung nicht farblos werden, so müssen Sie noch mehr Zinkpulver dazugeben.
- Filtrieren Sie die farblose Lösung.
- Geben Sie das Filtrat in ein Becherglas und stellen Sie zwei Kohleelektroden in das Becherglas. Schließen Sie eine Gleichspannungsquelle (4 V) an die Elektroden an und beobachten Sie.
- Schalten Sie nach einiger Zeit die Spannungsquelle aus und schließen Sie ein Voltmeter an die beiden Elektroden an.
- Verbinden Sie die beiden Elektroden mit einem Verbraucher (Lampe, Motor etc.). Falls kein Verbraucher zur Verfügung steht, verbinden Sie die beiden Elektroden mit einem Kabel. Der Zink-Iod-Akkumulator sollte sich jetzt entladen.
- Messen Sie nach einiger Zeit erneut die Spannung. Die Spannung sollte jetzt deutlich zurück gegangen sein.
- Schließen Sie wieder die Gleichspannungsquelle an und laden Sie den Akku wieder auf.
- Messen Sie jetzt erneut die Spannung zwischen den beiden Elektroden.
Dieser Versuch funktioniert immer sehr gut. Mit den Schritten 1 bis 3 stellen wir uns eine recht konzentrierte Zinkiodid-Lösung her. Wenn in der Schule Zinkiodid zur Verfügung steht, kann man sich die Schritte 1 bis 3 natürlich sparen.
Bei der Elektrolyse der Zinkiodid-Lösung in Schritt 4 kann man beobachten, dass sich der Minuspol mit einer grauen Schicht überzieht, während am Pluspol violette Schlieren zu sehen sind. Bei der grauen Schicht handelt es sich um metallisches Zink, das sich auf der Kohleelektrode absetzt, und die violetten Schlieren sind natürlich elementares Iod. Es findet also folgende Reaktion beim Aufladen statt:
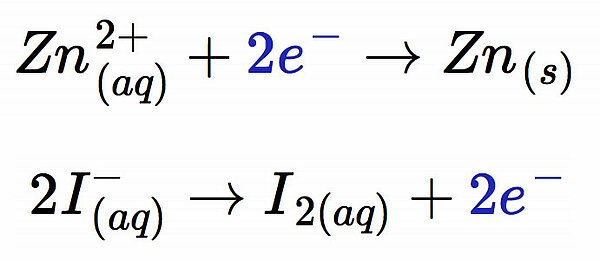
Damit haben wir eine Zink-Elektrode und eine Iod-Elektrode hergestellt. Einen ähnlichen Versuch hatten wir ja bereits bei der Besprechung der Redoxpotenziale der Nichtmetalle mit Zinkbromid-Lösung durchgeführt.
Bei Schritt 5 kann man dann eine Spannung beoachten, wenn man die beiden Elektroden mit einem Voltmeter verbindet. Allerdings verbraucht ein Voltmeter so gut wie keinen Strom, daher kommt es kaum zur Entladung des Akkus. Dazu müssen wir einen richtigen Verbraucher an die beiden Elektroden anschließen, zum Beispiel einen kleinen Motor oder eine Lampe. Wenn man nach ca. 10 bis 20 Minuten erneut die Spannung misst, sollte der Voltmeter schon deutlich weniger anzeigen als direkt nach dem Aufladen. Nun können wir in Schritt 8 ausprobieren, ob es sich tatsächlich um einen Akkumulator handelt oder nur um eine Batterie. Tatsächlich kann man das Zink-Iod-Element erneut aufladen; die angezeigte Spannung in Schritt 9 ist wieder deutlich höher. Es handelt sich also um einen echten Akkumulator, ein sogenanntes Sekundärelement, und nicht um eine Batterie, ein Primärelement.