Man könnte das Benzol-Molekül als ein Cyclohexan-Molekül mit drei konjugierten C=C-Doppelbindungen beschreiben:

Dumm nur, dass alle experimentellen Befunde gegen diese Darstellung sprechen. Auf zwei dieser Befunde wollen wir hier einmal etwas näher eingehen.
Zwei Befunde, die gegen ein Cyclohexan mit drei Doppelbindungen sprechen:- Gibt man Bromwasser zu Benzol, so tritt keine Entfärbung ein. Theoretisch sollte Benzol dreimal so gut mit Bromwasser reagieren wir Cyclohexen.
- Eine C=C-Doppelbindung ist deutlich kürzer als eine C-C-Einfachbindung. Die sechs C-C-Bindungen im Benzol-Molekül haben aber alle die gleiche Länge.
Wie kann man dieses eigenartige Verhalten des Benzols erkären?
Die C=C-Doppelbindung
Wir hatten gesehen, dass eine C=C-Doppelbindung aus zwei verschiedenen kovalenten Bindungen besteht. Bei der Bildung der sigma-Bindung überlappen zwei sp2-Hybridorbitale der beiden C-Atome. Diese kovalente Bindung ist sehr fest, da die sp2-Orbitale aufgrund ihrer räumlichen Struktur recht stark überlappen.
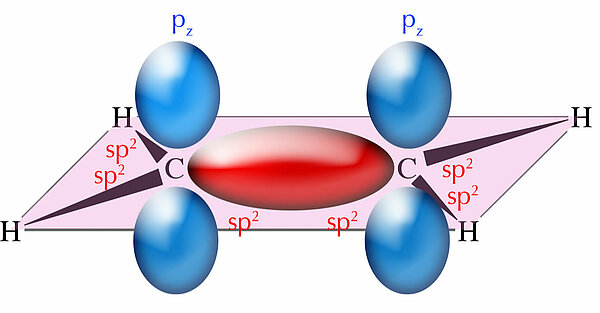
In der Abbildung ist diese sigma-Bindung rot dargestellt. Achten Sie nun auf die p-Orbitale in der Darstellung. Die beiden pz-Orbitale der beiden C-Atome ragen nach oben und unten aus der eingezeichneten Ebene heraus. Nun ist ein Orbital ja als "Aufenthaltsraum für Elektronen" definiert und hat eigentlich keine scharfen Grenzen. Auch außerhalb des eingezeichneten Orbitals existiert eine (sehr geringe) Wahrscheinlichkeit, ein Elektron anzutreffen. Daher kann man die beiden p-Orbitale auch überlappen lassen, so wie auf dem folgenden Bild gezeichnet:
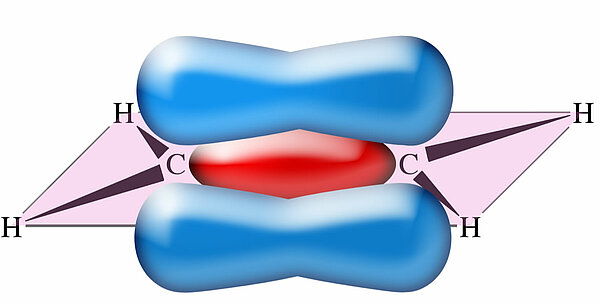
Allerdings ist diese Überlappung sehr schwach, sehr viel schwächer als bei der sigma-Bindung. Diese schwache kovalente Bindung wird als pi-Bindung bezeichnet.
Das Butadien-Molekül
Butadien ist ein Butan mit zwei konjugierten Doppelbindungen. Hier zunächst die Strukturformel:

Die C=C-Doppelbindungen zwischen den C-Atomen 1 und 2 sowie 3 und 4 sind hier nach dem Kugelwolkenmodell dargestellt, die bindenden Kugelwolken haben die Gestalt einer Banane. Nun wissen wir es aber besser. Jedes der vier C-Atome ist sp2-hybridisiert, und die vier pz-Orbitale ragen nach oben und unten aus der eingezeichneten Ebene heraus:
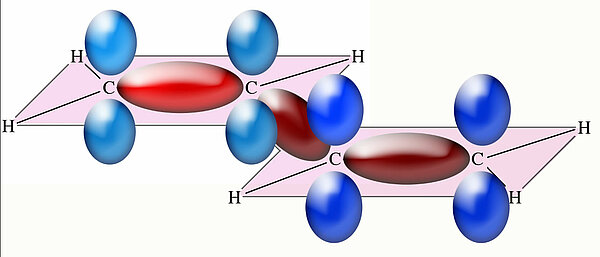
Man könnte nun denken: "Prima; wir haben zwei mal zwei pz-Orbitale, also werden sich auch zwei Doppelbindungen bilden". Die graphische Darstellung des Butadien-Moleküls sähe dann vielleicht so aus:
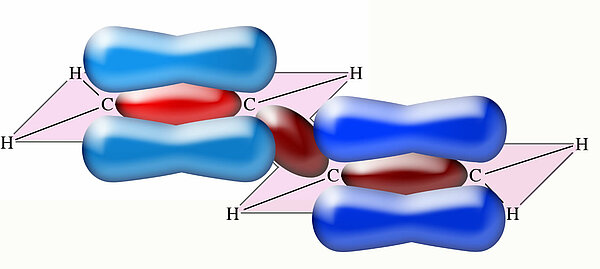
Diese Darstellung mit zwei einzelnen Doppelbindungen ist aber falsch! Auch die pz-Orbitale der C-Atome 2 und 3 können überlappen:
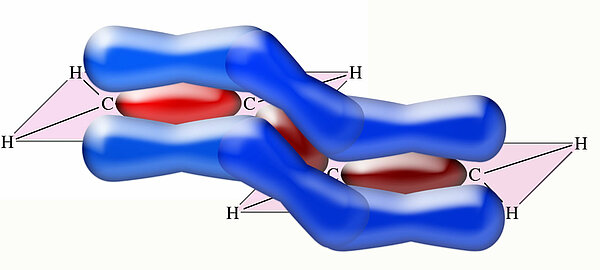
Hier komme ich allmählich mit meinem Graphikprogramm (Photoshop CS4) an die Grenzen des (für mich) Machbaren.
Sie müssen sich die überlappenden pz-Orbitale als einen einheitlichen Aufenthaltsraum für die vier Elektronen der pz-Orbitale vorstellen. Die vier Elektronen können sich innerhalb der oberen und unteren Orbitallappen frei bewegen; ihr Aufenthaltsort ist nicht mehr lokalisierbar, daher bezeichnet man diese Elektronen auch als delokalisierte Elektronen.
Das Benzol-Molekül
Beim Benzol-Molekül sind nicht vier sp2-hybridisierte C-Atome in einer Kette angeordnet wie beim Butadien, sondern sechs sp2-hybridisierte C-Atome in einem Ring:
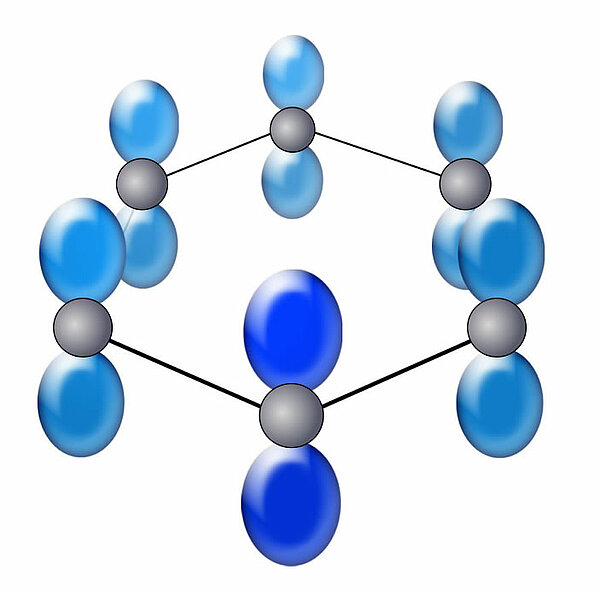
Diese sechs pz-Orbitale vereinigen sich nun zu einem Ring oberhalb der eingezeichneten Ebene und zu einem Ring unterhalb dieser Ebene. Die sechs Elektronen können sich frei in diesen beiden Ringen bewegen, sie sind delokalisiert.
Die Überlappung der pz-Orbitale habe ich mit Photoshop nicht mehr "hingekriegt", daher verzichte ich hier auf eine entsprechende Zeichnung.

Hier sehen wir aber eine schöne Zeichnung, die von Roland.chem unter der Creative Commons Attribution 3.0 Unported license in dem Benzol-Artikel der deutschen Wikipedia veröffentlicht wurde.
Nun zurück zu den
Befunden, die gegen ein Cyclohexan mit drei Doppelbindungen sprechen:
- Gibt man Bromwasser zu Benzol, so tritt keine Entfärbung ein. Theoretisch sollte Benzol dreimal so gut mit Bromwasser reagieren wir Cyclohexen.
- Eine C=C-Doppelbindung ist deutlich kürzer als eine C-C-Einfachbindung. Die sechs C-C-Bindungen im Benzol-Molekül haben aber alle die gleiche Länge.
Gleiche Bindungslängen
Fangen wir mit dem zweiten Befund an. In dem Benzol-Moleküle existieren keine C-C-Einfachbindungen und auch keine C=C-Doppelbindungen. Die pi-Bindungen resultieren aus der Überlappung der sechs pz-Orbitale. Die sechs pi-Elektronen halten sich in einem ringförmigen Aufenthaltsraum oberhalb und unterhalb der Ringebene auf, sie sind delokalisiert. Daher sind alle sechs C-C-Bindungen im Benzolring gleichwertig und haben dann auch die gleiche Bindungslänge.
Keine Entfärbung durch BromwasserDen ersten Befund zu erklären, ist schon etwas schwieriger. Die Additionsreaktion (elektrophile Addition) ist typisch für die C=C-Doppelbindung. Man könnte es sich nun einfach machen und sagen, da im Benzol keine C=C-Doppelbindungen existieren, kann Benzol auch keine elektrophile Addition eingehen.
Das stimmt zwar, aber in Wirklichkeit ist die Sache etwas komplizierter. Benzol könnte schon eine elektrophile Addition eingehen, aber dann würde der aromatische Charakter des Benzol-Moleküls zerstört. Der aromatische Charakter wird durch das Überlappen der sechs pz-Orbitale hervorgerufen. Weil die sechs pi-Elektronen über den ganzen Benzolring delokalisiert sind, ist dieser Zustand besonders energiearm. Durch eine elektrophile Addition würden zwei der sp2-hybridisierten C-Atome wieder in den sp3-hybridisierten Zustand wechseln. Die sp3-hybridisierten C-Atome hätten dann aber keine pz-Orbitale mehr, und der Aufenthaltsraum der verbliebenen vier pi-Elektronen wäre arg beschränkt, er würde dann dem des Butadiens gleichen. Dieser Zustand ist energetisch recht ungünstig, und das ist auch der Grund dafür, dass Benzol und verwandte aromatische Verbindungen eine elektrophile Addition nur sehr ungern eingehen.