Grundprinzip
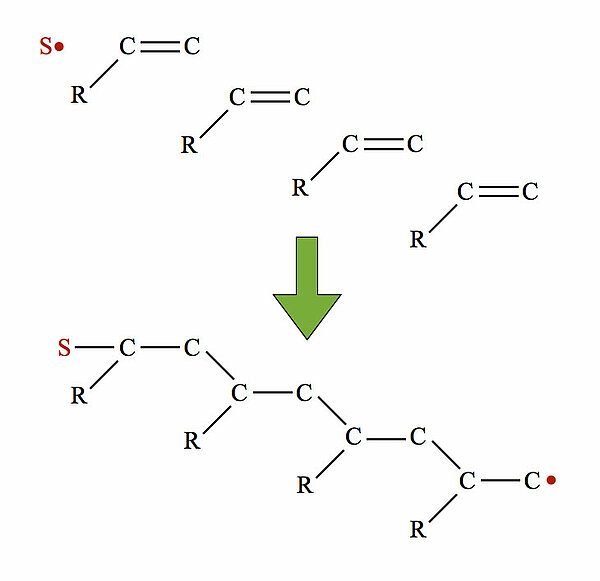
Hier ist das Grundprinzip der radikalischen Polymerisation dargestellt. In dem Bild sieht man vier Alken-Moleküle R-CH=CH2 (Doppelbindung zwischen den beiden ersten C-Atomen) sowie ein Starter-Radikal. Die Alken-Moleküle sind stark vereinfacht dargestellt; wichtig sind hier nur die C=C-Doppelbindungen. Bei der Polymerisation "klappen" die Doppelbindungen auf, wodurch einfach besetzte Kugelwolken bzw. Orbitale entstehen, die dann die Verbindung zu benachbarten Alken-Einheiten herstellen. Das zuletzt "angebaute" Alken-Molekül hat wieder ein einfach besetztes Orbital ("einsames Elektron"), so dass sich ein weiteres Alken-Molekül anlagern kann.
Der Großteil der heutigen Kunststoffe wird durch Polymerisation gewonnen, allein Polyethylen (PE) hat einen Marktanteil von ca. 30%.
Mechanismus
Die Bildung von Polyethylen, Polypropylen, Polyvinylchlorid, Polystyrol etc. geschieht nach einem radikalischen Mechanismus (siehe auch radikalische Addition).
KettenstartEin relativ instabiles Molekül wird durch Wärme- oder Lichtenergie homolytisch in zwei Starter-Radikale S* gespalten.
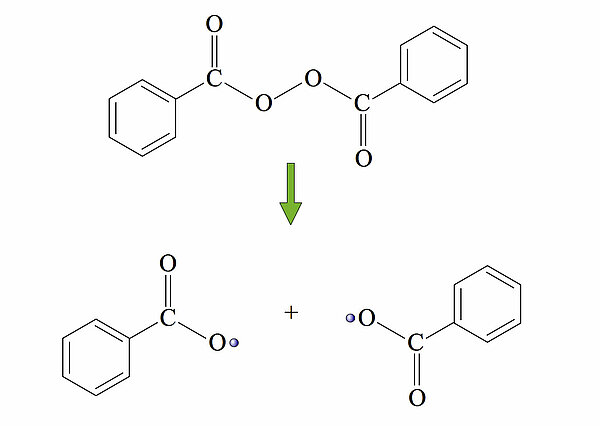
Hier sieht man den Zerfall von Dibenzoylperoxid in zwei Benzoesäure-Radikale. Aber die Zerfallsreaktion des Dibenzoylperoxids ist noch nicht abgeschlossen, es kommt noch ein Zerfallsschritt:
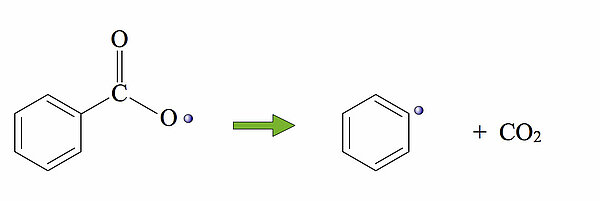
Jetzt haben wir einen höchst reaktiven Benzolring mit einem einsamen radikalischen Elektron.
Kettenwachstum
Das Radikal und ein Alken-Molekül stoßen zusammen. R steht dabei für den variablen Rest. Im Falle von Polyethylen ist R einfach ein H-Atom, im Fall von Polypropylen eine Methylgruppe, beim Polystyrol ein ganzer Benzolring.
Dabei "klappt" die C=C-Doppelbindung des Alkens auf, kurzzeitig befindet sich an jedem C-Atom der ehemaligen Doppelbindung ein ungepaartes freies Elektron. Das freie Elektron des "linken" C-Atoms verbindet sich nun mit dem freien Elektron des Radikals, es entsteht eine neue kovalente Bindung. Das freie Elektron des "rechten" C-Atoms findet dagegen keinen Partner und bleibt "einsam" bzw. radikalisch.
Aus dem Starter-Radikal und dem ersten Alken-Molekül ist ein neues, größeres Radikal geworden. Dieses reagiert nun mit einem zweiten Alken-Molekül:
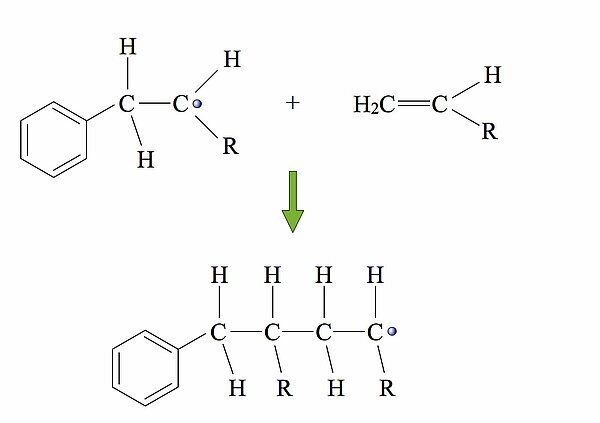
Und so geht das weiter. Bei der industriell durchgeführten Polymerisation von Alkenen entstehen Makromoleküle, die aus ca. 1.000 bis 50.000 Monomeren bestehen.
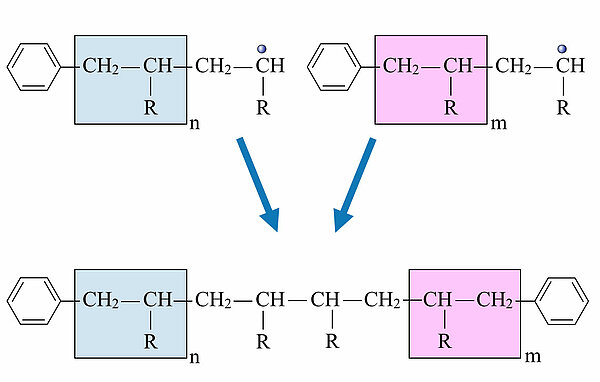
KettenabbruchDer Abbruch der Kettenreaktion findet dann statt, wenn entweder keine Monomere im Reaktionsgemisch mehr vorhanden sind, oder wenn zwei Radikale zusammenstoßen. Letzteres kann man auch absichtlich herbeiführen, indem man spezielle Stopp-Moleküle zufügt, die in Radikale zerfallen und so die Wahrscheinlichkeit eines Kettenstopps erhöhen.
Die folgenden drei Bilder zeigen typische Kettenabbruchreaktionen dieser radikalischen Polymerisation.