Beispiel Wasserstoff-Molekül
Die Molekül-Orbital-Theorie lässt sich am besten bzw. am einfachsten am Beispiel des H2-Moleküls erklären. Ein Wasserstof-Molekül besteht aus zwei gleichen Atomen, nämlich zwei Wasserstoff-Atomen. Jedes Wasserstoff-Atom besitzt nur ein einziges Atom-Orbital, das 1s-Orbital, das mit nur einem Elektron besetzt ist.
Rückblick auf die Sekundarstufe IIm Unterricht dere Sekundarstufe I lernt man, dass sich die beiden "einfach besetzten Kugelwolken" der beiden H-Atome überlappen. So ensteht eine "gemeinsame Kugelwolke", die mit zwei Bindungselektronen besetzt ist. Diese beiden Bindungselektronen halten sich zwischen den positiv geladenen Atomkernen auf und halten diese Atomkerne so zusammen. Ohne den negativen "Elektronenkitt" würden sich die beiden Atomekerne abstoßen.
Das H2-Molekül nach der MO-TheorieNach der MO-Theorie überlappen die beiden 1s-Orbitale der beiden H-Atome, man sagt auch, sie kombinieren. Durch die Kombination dieser beiden Orbitale entstehen zwei Molekülorbitale (MOs), ein bindendes und ein antibindendes. Das bindende MO hat eine niedrigere Energie als die beiden 1s-Orbitale der Atome, während das antibindende ein höheres Energieniveau hat als die 1s-Orbitale der Atome. Graphisch kann man das ungefähr so darstellen:
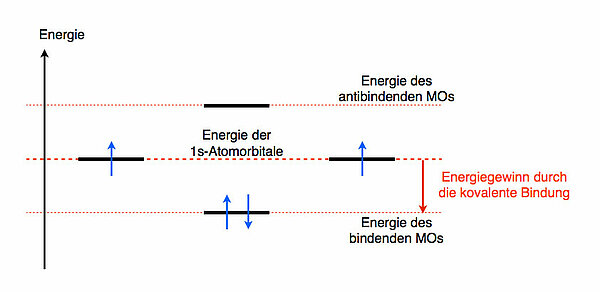
Wieso gibt es überhaupt ein bindendes und ein antibindendes Molekülorbital?
Nach der gängigen Vorstellung der Quantenchemie kann man Elektronen nicht nur als Teilchen betrachten, sondern auch als Wellen. Das ist zwar für den normalen Menschenverstand schwer vorstellbar, aber was soll's; Physiker haben damit kein Problem. Nach dieser abstrakten Vorstellung sind Elektronen allerdings keine normalen (eindimensionalen) Wellen, sondern dreidimensionale.
Aber wir stellen uns jetzt einmal zwei normale eindimensionale Wellen vor:

Zwei eindimensionale Wellen können sich auf verschiedene Weisen gegenseitig überlagern. Dabei sind zwei Extremfälle zu unterscheiden. Im ersten Extremfall überlagern sich die Wellen so, dass die Wellenberge der einen Welle exakt auf die Wellenberge der anderen Welle treffen. Die beiden Wellen addieren sich, es entsteht eine neue Welle mit doppelt so großer Amplitude (Höhe der Wellenberge). Das andere Extrem liegt dann vor, wenn der Wellenberg der einen Welle exakt auf ein Wellental der anderen Welle trifft. Haben beide Wellen die gleiche Wellenlänge und Amplitude, dann löschen sich die beiden Wellen gegenseitig aus.
Dieses Phänomen nutzt man übrigens technisch aus bei der Konstruktion von noise-chancelling-Kopfhörern. Ein Mikrophon nimmt die Geräusche aus der Umgebung auf. Dann werden die Schallwellen um genau eine halbe Wellenlänge "verschoben" und dem Hörer über die Kopfhörer eingespielt. Die "echten" Schallwellen, die den Kopfhörer durchdringen, werden dann von diesen phasenverschobenen Wellen ausgelöscht.
Atomorbitale muss man sich wie dreidimensionale Wellen vorstellen. Auch Atomorbitale können sich gegenseitig verstärken oder auslöschen. Bei der Bildung der bindenden Molekülorbitale verstärken sich die beiden 1s-Orbitale der H-Atome gegenseitig, und bei der Bildung der antibindenden MOs löschen sich die beiden Atomorbitale gegenseitig aus.
Die Energie des bindenden MOs liegt unter der Energie der beiden Atomorbitale. Daher wird dieses MO "gerne" von den beiden Elektronen besetzt. Die resultierende kovalente Bindung (s-s-Überlappung) ist daher energieärmer und somit "energetisch günstiger" als der Zustand der nicht-verbundenen Atome.
Beispiel Ethen-Molekül
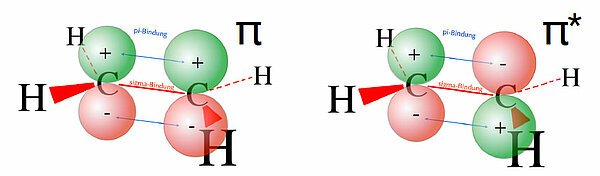
Auch bei größeren Molekülen kann man die MO-Theorie anwenden. Betrachten wir als Beispiel das Ethen-Molekül. Um nicht die Übersicht zu verlieren, konzentrieren wir uns dabei auf die beiden pz-Orbitale der sp2-hybridisierten C-Atome des Ethens.
Achten Sie auf die Ausrichtung der pz-Orbitale. Links in der Abbildung befinden sich die beiden grün gefärbten Orbitallappen "oben" im Molekül. Wenn die pz-Orbitale so ausgerichtet sind, addieren sich die "Wellenberge" der dreidimensionalen Wellen, und es entsteht ein bindendes Molekülorbital. So entsteht die normale pi-Bindung zwischen den beiden C-Atomen.
Rechts in der Abbildung sind die beiden pz-Orbitale jedoch entgegengesetzt ausgerichtet. Beim linken C-Atom zeigt der grüne Lappen (der Wellenberg) nach oben, beim rechten C-Atom aber nach unten. Wenn die pz-Orbitale so ausgerichtet sind, findet quasi eine Subtraktion der dreidimensionalen Wellen statt. So erklärt sich das Zustandekommen des antibindenden Molekülorbitals.
MO-Theorie und Farbstoffchemie
Ein Molekül wie Butadien hat vier dieser pz-Orbitale an benachbarten C-Atomen, so dass diese Orbitale überlappen können. Nun gibt es immer genau so viele MOs, wie pz-Orbitale beteiligt sind. Mit vier pz-Orbitalen erhalten wie also vier MOs, genauer gesagt, vier pi-MOs, denn die anderen MOs vernachlässigen wir in der Farbstoffchemie und überhaupt in der organischen Chemie. Von diesen vier MOs sind zwei bindend und zwei antibindend.
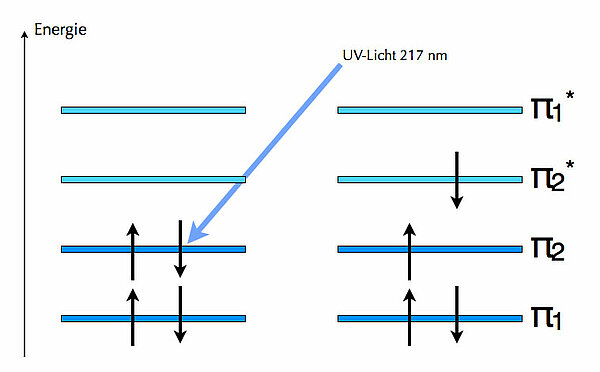
Die vier Elektronen verteilen sich auf die vier MOs nach einem ganz einfachen Prinzip: Mit der Besetzung wird unten angefangen, und in jedes MO passen maximal zwei Elektronen. Daher ergibt sich der oben links dargestellte Zustand, dass nur die beiden bindenden pi-MOs besetzt sind. Durch Absorption von UV-Licht der Wellenlänge 217 nm kann aber eines der beiden Elektronen des oberen besetzten MOs in das untere noch nicht besetzte antibindende MO befördert werden. Weitere Einzelheiten dazu siehe die entsprechenden Seiten in der Farbstoffchemie.