Eine chemische Bindung zwischen zwei Atomen, bei der sich die beiden Atome zwei Bindungselektronen teilen.
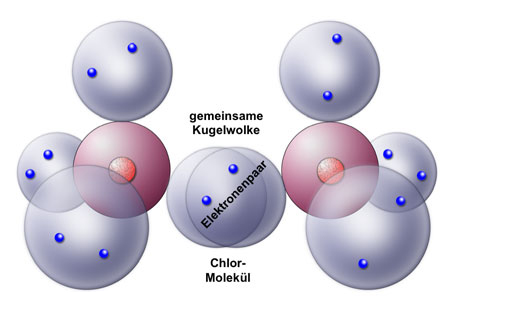
Hier sehen wir die kovalente Bindung innerhalb des Chlor-Moleküls. Jedes Chlor-Atom besitzt auf der Außenschale vier Kugelwolken. Drei davon sind mit Elektronenpaaren besetzt, eine Kugelwolke aber enthält nur ein Elektron. Bei der kovalenten Bindung überlappen nun die beiden einfach besetzten Kugelwolken der beiden Chlor-Atome und bilden eine gemeinsame Kugelwolke, die mit zwei Elektronen gefüllt ist. Man spricht hier auch von einem bindenden Elektronenpaar. Aus diesem Grund wird die kovalente Bindung auch sehr oft als Elektronenpaarbindung bezeichnet.
Unpolare Bindung
Beim Chlor-Molekül haben beide Atome die gleiche Elektronegativität, ziehen also die beiden Bindungselektronen gleich stark an. Die Folge ist, dass sich die beiden Elektronen gleichmäßig verteilt in der gemeinsamen Kugelwolke aufhalten.
Polare Bindung
Haben die beiden Atome der kovalenten Bindung jedoch unterschiedliche EN-Werte, wie im Beispiel Sauerstoff-Wasserstoff (OH-Gruppe, Wasser-Molekül), so halten sich die beiden Bindungselektronen statistisch öfter in der Nähe des elektronegativeren Atoms (in diesem Fall also Sauerstoff) auf. Die gemeinsame Kugelwolke hat dann ein leicht negatives und ein leicht positives Ende. Eine solche kovalente Bindung wird auch als polare Bindung bezeichnet.