Katalysatoren sind Elemente oder Verbindungen, die in der Lage sind, die Aktivierungsenergie einer chemischen Reaktion deutlich zu senken, so dass die Reaktionsgeschwindigkeit erheblich gesteigert wird. Reaktionen, die sonst Tage oder Wochen dauern würden, laufen mit Hilfe eines Katalysators innerhalb weniger Sekunden oder gar Millisekunden ab.
Es gibt grundsätzlich verschiedene Arten von Katalysatoren. Allen Katalysatoren ist aber gemein, dass sie an der chemischen Reaktion formal nicht teilnehmen. Das heißt, sie tauchen in der Reaktionsgleichung nicht auf, höchstens als Bemerkung über dem Reaktionspfeil, nicht aber als Edukt oder Produkt.
Bei den chemischen und biochemischen Reaktionen, die auf diesen Webseiten besprochen werden, sind vor allem zwei Arten von Katalysatoren wichtig. Einmal die Katalysatoren, die dazu dienen, die Wahrscheinlichkeit eines erfolgreichen Zusammenstoßes zwischen den Molekülen der Edukte zu erhöhen. Und zum anderen die Katalysatoren, die durchaus an der chemischen Reaktion teilnehmen, am Ende der Reaktion aber wieder regeneriert werden, so dass sie nicht in der Reaktionsgleichung auftauchen.
Typ 1: Erhöhung der Stoßwahrscheinlichkeit
Bei einer chemischen Reaktion des Typs A + B ==> C müssen die Edukt-Teilchen A und B nicht nur einfach "zusammenstoßen", damit es zur Bildung des Produkt-Teilchens C kommt, sondern der Zusammenstoß muss mit einer bestimmten Mindestenergie erfolgen. Durch Erhöhung der Temperatur kann man die Geschwindigkeit v der Teilchen und somit deren kinetische Energie EKin erhöhen und so die Wahrscheinlichkeit eines erfolgreichen Zusammenstoßes steigern.
Aber die kinetische Energie allein ist nicht der entscheidende Faktor. Die Teilchen müssen auch in der richtigen Orientierung vorliegen, sofern es sich nicht um sehr einfache Teilchen wie zum Beispiel Magnesium-Atome und Sauerstoff-Moleküle handelt. Betrachten wir als Beispiel einmal die Veresterung von Methansäure mit Methanol:
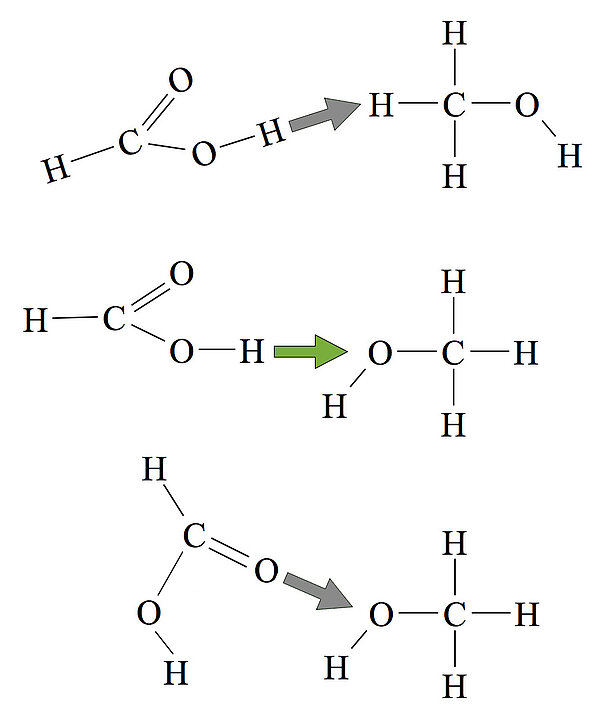
Das Bild zeigt drei verschiedene Möglichkeiten, wie ein Methansäure-Molekül auf ein Methanol-Molekül stoßen kann. Die Geschwindigkeit der Teilchen ist bei allen drei Fällen gleich hoch, und die kinetische Energie der Teilchen reicht auch aus für einen erfolgreichen Zusammenstoß. Dennoch werden sich nur bei einer der drei Möglichkeiten Produktmoleküle bilden.
Im oberen Fall stoßen die Teilchen in einer völlig falschen Orientierung aufeinander. Das H-Atom des Methanols kann mit der OH-Gruppe der Methansäure nicht reagieren. Im mittleren Fall ist die Orientierung optimal. Die OH-Gruppe des Methanols reagiert mit der OH-Gruppe der Säure, und ein Ester kann sich bilden. Im unteren Fall könnte es eventuell auch zu einer Reaktion kommen, die Orientierung ist aber nicht so optimal wie beim mittleren Fall. Die Wahrscheinlichkeit eines erfolgreichen Zusammenstoßes ist also im mittleren Fall am größten.
Ein Katalysator, der die Reaktion dieser beiden Moleküle erleichtert, bindet nun beide Edukt-Moleküle so, dass die beiden OH-Gruppen einander gegenüberliegen.
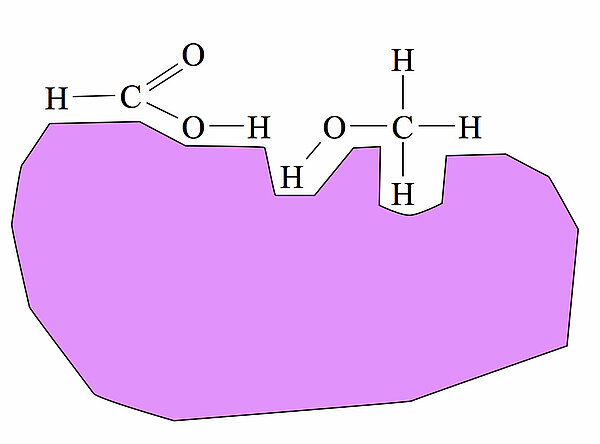
Die Wahrscheinlichkeit eines erfolgreichen Zusammenstoßes wird so drastisch erhöht, und die Aktivierungsenergie der Reaktion wird so gesenkt. Entsprechend steigt die Reaktionsgeschwindigkeit an.
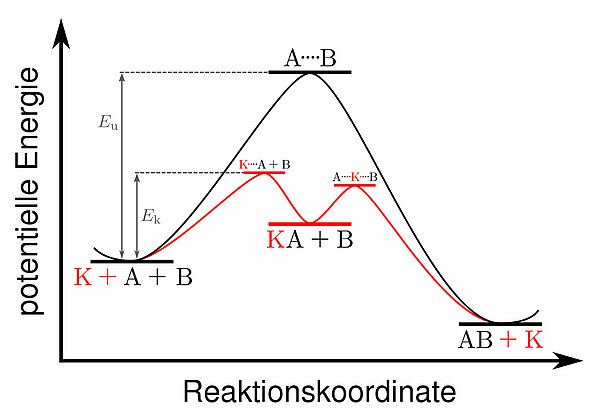
Auf diesem Bild (Wikipedia, public domain) sieht man die Arbeitsweise eine Katalysators. In schwarz ist die unkatalysierte Reaktion zwischen A+B dargestellt; die Aktivierungsenergie ist recht hoch, und die Reaktion läuft bei Zimmertemperatur nur langsam ab.
In rot sieht man die katalysierte Reaktion. Zunächst bindet der Katalysator K das Edukt A, die Aktivierungsenergie für diesen Schritt ist nicht allzu hoch. Im zweiten Schritt bindet der Katalysator das Edukt B, auch hier ist die Aktivierungsenergie recht klein.
Typ 2: Teilnahme an der Reaktion und Regeneration
Für diese Art der Katalyse gibt es ein schönes Beispiel aus der Welt der Märchen und Sagen. Ein alter Mann vererbt seinen drei Söhnen 17 Kamele. In seinem Testament hat er bestimmt, dass der älteste Sohn die Hälfte, der zweitälteste Sohn ein Drittel und der jüngste Sohn ein Neuntel der Kamele erhalten soll. Nun kann man 17 Kamele nicht einfach so aufteilen, zumindest nicht ohne sie zu schlachten. Also baten die drei Söhne einen weisen Mann um Rat, und der kam dann auf die tolle Idee: Ich schenke euch mein eigenes Kamel, und dann könnt ihr die Kamele eures Vaters ohne Problem aufteilen. Gesagt, getan. Der älteste Sohn bekam neun Kamele, genau die Hälfte. Der zweitälteste Sohn erhielt sechs Kamele, also sein Drittel. Und der jüngste Sohn bekam zwei Kamele, also genau das versprochene Neuntel. Neun und sechs und zwei Kamele sind zusammen aber 17 Kamele, also blieb ein Kamel übrig. Das nahm der Weise wieder an sich, zog von dannen und beschloss, ein Buch über Katalysatoren zu schreiben.
Genau so verhalten sich manche chemischen Stoffe bei Reaktionen. Sie stellen am Anfang der Reaktion beispielsweise ein Proton zur Verfügung, das Proton setzt sich an eines der Edukte, das Edukt reagiert weiter, und irgendwann, meistens beim letzten Reaktionsschritt, wird das Proton wieder freigesetzt, als ob nichts geschehen wäre. Oder es wird ein anderes Proton stattdessen freigesetzt, aber insgesamt hat, zumindest formal gesehen, kein Proton an der Reaktion teilgenommen. Aber ohne dieses Proton hätte die Reaktion nicht ablaufen können, oder es hätte ewig gedauert, bis die Reaktion abgelaufen wäre. Also kann man dieses Proton durchaus auch als Katalysator bezeichnen.