Das Bromonium-Ion tritt bei der Bromierung von Alkenen wie zum Beispiel Ethen als Zwischenprodukt auf.
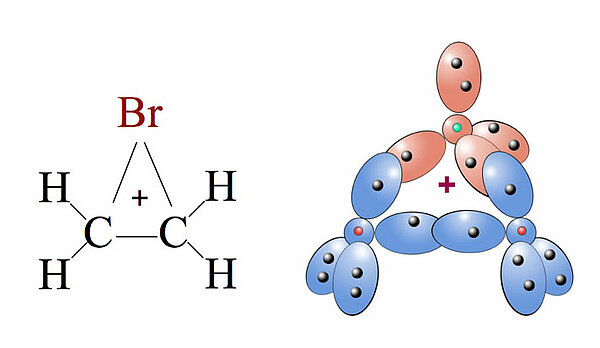
Links sehen Sie die klassische Darstellung des Bromonium-Ions nach der LEWIS-Schreibweise, rechts sehen Sie einen Versuch, das Bromonium-Ion mit Hilfe des Kugelwolkenmodells darzustellen.
Das Br+-Ion, das ja durch heterolytische Spaltung des Br2-Moleküls entstanden ist, hat zwei doppelt besetzte Kugelwolken und zwei einfach besetzte. Die pi-Bindung der C=C-Doppelbindung hat sich in ihre beiden Kugelwolken aufgetrennt, und jede dieser einfach besetzten Kugelwolken überlappt jetzt mit einer der einfach besetzten Kugelwolken des Br+-Ions.
Die positive Ladung ist nicht mehr auf das Br+-Ion beschränkt, sondern verteilt sich über den ganzen Ring aus dem Br-Atom und den beiden C-Atomen der ursprünglichen Doppelbindung. Man spricht hier auch von einer Delokalisierung der positiven Ladung. Allerdings liegt der Schwerpunkt der positiven Ladung beim Brom (Chemgapedia).
Die delokalisierte positive Ladung des Bromonium-Ions zieht nun nucleophile Teilchen wie Bromid-Ionen oder Hydroxid-Ionen an. Dabei ist das Bromonium-Ion nur von der Rückseite her frei zugänglich, also von der dem Brom-Atom entfernten Seite. Es findet daher eine sogenannte anti-Addition des Nucleophils statt, ein sogenannter Rückseiten-Angriff, was man bei Cyclohexen sehr leicht experimentell nachweisen konnte:
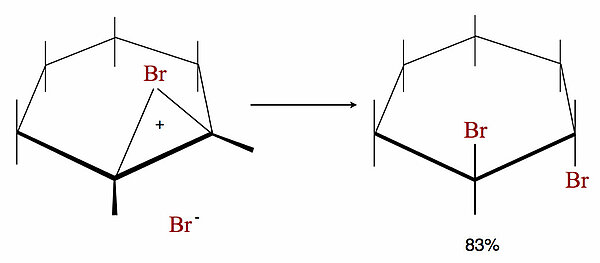
Das trans-Produkt bildet sich zu 83%, das cis-Produkt nur zu 17%.