Allgemeines
Antibiotika im engeren Sinn sind niedermolekulare Stoffwechselprodukte (keine Enzyme!) von Mikroorganismen, die bereits in geringen Konzentrationen das Wachstum anderer Mikroorganismen hemmen oder diese sogar töten[1].
Heute versteht man unter dem Begriff Antibiotika aber auch synthetisch hergestellte Wirkstoffe gegen Mikroorganismen sowie aus Pflanzen oder Tieren gewonnene Stoffe, die Mikroorganismen hemmen oder töten[1].
Daher teilt man Antibiotika grundsätzlich in zwei große Klassen ein
- Bakteriostatisch: Bakterien werden in ihrem Wachstum oder in ihrer Vermehrung gebremst, jedoch nicht getötet
- Bakterizid: Bakterien werden abgetötet[2].
Das grundsätzliche Problem bei Antibiotika ist, dass sie zwar Bakterienzellen im Wachstum hemmen oder diese sogar abtöten sollen, nicht aber die menschlichen oder tierischen Zellen, die von den Bakterien befallen sind. Antibiotika müssen also Strukturen oder Funktionen der Bakterienzellen angreifen, die sich von den entsprechenden Strukturen bzw. Funktionen der menschlichen bzw. tierischen Zellen unterscheiden.
Man kann Antibiotika nach ihrer Herkunft, nach ihrer Wirkung und nach ihrer chemischen Struktur unterscheiden.
Unterteilung der Antibiotika nach ihrer chemischen Struktur
β-Lactame
Zu diesen Antibiotika gehören die wohl ältesten und bekanntesten Antibiotika, die Penicilline. Zu dieser Gruppe gehören neben Penicillin selbst verwandte Verbindungen wie Amoxicillin und Ampicillin.
Eine andere bekannte Gruppe von β-Lactamen sind die vielen Cephalosporine, deren Namen alle mit "Cef" anfangen.
Chemische Struktur
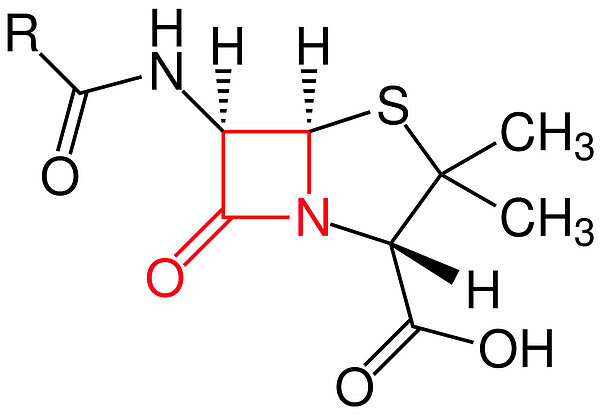
Die β-Lactame haben ihren Namen von dem Lactamring, einem aus drei C-Atomen und einem N-Atom bestehenden Ring; das eine C-Atom ist außerdem mit einem O-Atom durch eine Doppelbindung verbunden (Carbonylgruppe).
Wirkung
Die β-Lactame blockieren bakterielle Enzyme, die für den Aufbau der Zellwand zuständig sind. Dadurch bekommt die bakterielle Zellwand Löcher, die dann zum Absterben der Zelle führen.
Da β-Lactame von anderen Mikroorganismen als Abwehrstoffe gegen Bakterien auf natürliche Weise produziert werden, und das schon seit Jahrmillionen von Jahren, haben die Bakterien natürlich im Laufe der Evolution Abwehrmechanismen gegen diese Antibiotika entwickelt. Manche Bakterien bilden daher β-Lactamasen, das sind Enzyme, die in der Lage sind, β-Lactame zu spalten und dadurch unschädlich zu machen. Ist ein Mensch oder ein Tier von solchen Bakterien befallen, wirken die β-Lactame nicht mehr. In diesem Fall werden dann zusätzlich β-Lactamase-Inhibitoren gegeben. Das sind Verbindungen, welche die β-Lactamasen der Bakterien unschädlich machen[2,3].
Glycopeptide
Auch diese Antibiotika wirken auf die bakterielle Zellwandsynthese ein, allerdings nach einem anderen Wirkmechanismus als die β-Lactame. Im Endeffekt entstehen aber auch hier Löcher in der Zellwand, die schließlich zum Tod der Bakterien führen. Wie der Name schon andeutet, handelt es sich bei den Glycopeptiden um kleine Peptide, die mit Zuckerresten verbunden sind.
Polyketide
Zu dieser Gruppe von Antibiotika gehören die bekannten Tetracyclinesowie die Makrolid-Antibiotika.
Struktur der Tetracycline[4]
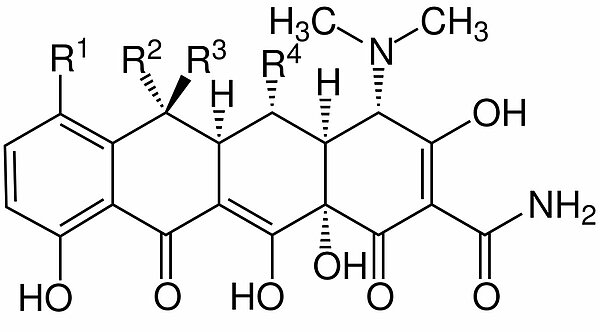
Wie man leicht sieht, enthalten die Tetracycline vier teils aromatische Ringe, die vom Benzol abgeleitet sind. Daher auch der Name: Tetra = vier, cyclin = Ring.
Wirkung der Tetracycline
Tetracycline hemmen die bakterielle Translation. Sie lagern sich an die kleine Untereinheit der Ribosomen an.
Die kleine Ribosomenuntereinheit der Bakterien ist etwas leichter (30 S) als die entsprechende kleine Ribosomenuntereinheit der Tiere und Menschen (40 S), daher können Tetracycline diese Untereinheit gezielt angreifen, ohne die Ribosomen in den menschlichen / tierischen Zellen zu schädigen.
Die Tetracyline lagern sich derart an die kleine Ribosomenuntereinheit an, dass die beladenen tRNA-Moleküle nicht mehr andocken können. Dadurch wird die Translation an entscheidender Stelle verhindert.
Wirkung der Makrolid-Antibiotika
Auch diese Verbindungen blockieren die bakterielle Translation. Allerdings lagern sich die Moleküle nicht an die kleine Ribosomenuntereinheit an, sondern an die große. Sie setzen sich an den "Tunnel", durch den das frisch synthetisierte Peptid das Ribosom verlässt. Das wohl bekannteste Makrolid-Antibiotikum ist das Erythromycin, ein Glycosid.
Aminoglycosid-Antibiotika
Bei den Aminoglycosid-Antibiotika handelt es sich um eine "große, anwachsende Gruppe von ca. 200 wasserlöslichen antibiotisch wirksamen Substanzen, von denen viele arzneilich verwendet werden"[5]. Das wohl bekannteste Aminoglycosid-Antibiotikum ist Streptomycin, das bereits 1943 entdeckt wurde und als erstes Antibiotikum gegen Tuberkulose eingesetzt wurde. Andere bekannte Aminoglycosid-Antibiotika sind Kanamycin und Neomycin.
Struktur

Wie man auf dem Bild sieht, enthalten die Aminoglycosid-Antibiotika einige Aminogruppen ("Amino-") und mehrere an Glucose angelehnte Zuckerringe ("-glycosid").
Wirkung
Die Aminoglycosid-Antibiotika lagern sich an die kleine Untereinheit der bakteriellen Ribosomen an. Allerdings verhindern sie die Anlagerung der tRNA nicht vollständig, sondern bewirken Ablesefehler der mRNA. Es werden also fehlerhafte Proteine gebildet, die in ihrer biologischen Funktion beeinträchtigt sind, was schließlich zum Absterben der Bakterien führt.
Polypeptid-Antibiotika
Zu dieser Klasse von Antibiotika gehören über 300 verschiedene Verbindungen, deren Klassifizierung "äußerst kompliziert" ist[6]. Man unterscheidet grundsätzlich zwischen linearen und cyclischen Peptid-Antibiotika, wobei die ringförmigen dominieren. Wie kompliziert die Klassifizierung ist, zeigt der Artikel "Polypeptid-Antibiotika" in dem Lexikon der Chemie des Spektrum-Verlags. Hier werden beispielsweise die Cephalosporine und die Actinomycine zu den Polypeptid-Antibiotika gezählt, weil diese Verbindungen Peptidgruppen enthalten. Cephalosporine enthalten aber gleichzeitig auch einen Lactamring, so dass sie genau so gut zur Gruppe der β-Lactame gezählt werden können.
Chinolon-Antibiotika
Struktur

Chemisch leiten sich die Chinolon-Antibiotika von der aromatischen Verbindunjg Chinolin ab, einem Naphthalin, bei dem ein C-Atom durch ein N-Atom ersetzt wurde.
Wirkung
Die Chinolon-Antibiotika sind Gyrase-Hemmer, das heißt, sie hemmen das für die bakterielle DNA-Replikation notwendige Enzym Gyrase. Die Gyrase kommt nur in Bakterien vor. Das Enzym hilft beim Entwinden der DNA, wie es für die Replikation notwendig ist. Nach erfolgter Replikation hilft die Gyrase dabei, die DNA wieder in ihren ursprünglichen Zustand zurück zu führen. Diesen wichtigen Schritt verhindern Gyrase-Hemmer. Die Folge ist, dass die DNA entwunden bleibt und sich so nicht mehr verdoppeln kann. Das Bakterium kann sich nicht mehr teilen, die Vermehrung der Bakterien wird so effektiv verhindert[7].
Sulfonamide
Struktur
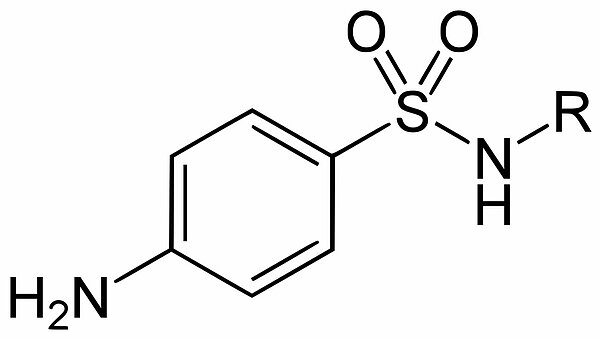
Sulfonamide bestehen aus einem Benzolring, an dessen einer Seite sich eine Aminogruppe befindet. Gegenüber liegt eine Sulfongruppe, die mit einem Amid (R-NH2) verbunden ist. Der Rest R kann dabei recht komplex aufgebaut sein.
Wirkung
Sulfonamide hemmen in den Bakterien die Synthese von Dihydrofolsäure, einer Vorstufe der Tetrahydrofolsäure. Tetrahydrofolsäure ist eine Verbindung, die für die Herstellung von Purinen wie Adenin und Guanin benötigt wird. Purinbasen sind bekanntlich essentielle Bestandteile der DNA. Sulfonamide hemmen also auf indirekte Weise die Bildung von DNA in den Bakterienzellen[8].
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia, Artikel "Antibiotikum", abgerufen am 7. August 2019
- Wikipedia, Artikel "β-Lactam-Antibiotika", abgerufen am 7. August 2019
- Wikipedia, Artikel "Tetracycline", abgerufen am 7. August 2019
- Wikipedia, Artikel "Aminoglykosid-Antibiotika", abgerufen am 7. August 2019
- Lexikon der Chemie, Spektrum-Verlag, Artikel "Polypepditantibiotika", abgerufen am 7. August 2019
- Wikipedia, Artikel "Chinolon-Antibiotika", abgerufen am 7. August 2019
- Lexikon der Biologie, Spektrum-Verlag, Artikel "Sulfonamide", abgerufen am 7. August 2019